Segundo principio de la termodinámica
La segunda ley de la termodinámica da una definición precisa de una propiedad llamada entropía. La entropía puede considerarse como una medida de lo próximo o no que se halla un sistema al equilibrio; también puede considerarse como una medida del desorden (espacial y térmico) del sistema. La segunda ley afirma que la entropía, o sea, el desorden, de un sistema aislado nunca puede decrecer. Por tanto, cuando un sistema aislado alcanza una configuración de máxima entropía, ya no puede experimentar cambios: ha alcanzado el equilibrio. La naturaleza parece pues "preferir" el desorden y el caos. Puede demostrarse que el segundo principio implica que, si no se realiza trabajo, es imposible transferir calor desde una región de temperatura más baja a una región de temperatura más alta.
Entropía: Es una función del estado del sistema, ya que tiene un valor único para cada estado, independiente de cómo el sistema llego a dicho estado.
| ΔS = | ΔQ |
| T |
La entropía es una propiedad intrínseca del STD relacionada fundamentalmente con parámetros mensurables que la caracterizan.
| dS = | dQ |
| T |
dS: entropía del STD.
dQ: intercambio de energía térmica entre el medio y el STD.
T: temperatura a la que se registra el intercambio de energía térmica entre el medio y el STD.
La expresión permite el cálculo de variaciones pero no el conocimiento de valores absolutos.
La variación entrópica en cualquier STD y su ambiente considerado conjuntamente es positiva, tendiendo a cero en los procesos reversibles.
ΔSTotal ≥ 0 (proceso irreversible)
ΔS = 0 (proceso reversible)
Entropía como probabilidad:
Es menos probable que las 5 moléculas se encuentren en el lugar de origen a que se encuentren desparramadas luego de quitar el separador. La mayor cantidad del tiempo se hallarán desparramadas, por lo cual el estado 2 será de mayor entropía que el 1.
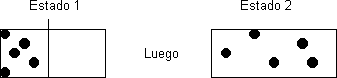
Entropía como probabilidad
El estado de equilibrio de un sistema aislado, es el de mayor desorden ya que es el más probable.
El aumento de entropía corresponde a un incremento del desorden molecular.
El segundo principio impone una condición adicional a los procesos termodinámicos. No basta con que se conserve la energía y cumplan así el primer principio. Una máquina que realizara trabajo violando el segundo principio se denomina "móvil perpetuo de segunda especie", ya que podría obtener energía continuamente de un entorno frío para realizar trabajo en un entorno caliente sin coste alguno.
1° ley: STD y entorno ΔESTD + ΔEAmbiente = 0
1° ley: STD ΔESTD = 0
2° ley: STD y entorno ΔSSTD + ΔSAmbiente ≥ 0
2° ley: STD ΔSSTD = 0
Cuando ΔSSTD = 0, el sistema está en equilibrio y no hay transformaciones entre los distintos tipos de energía.
Cuando ΔSSTD > 0, es un proceso desequilibrado y tendiendo hacia el equilibrio, siempre con:
ΔESTD = 0.
Autor: Anselmo Robles Bentham. Argentina.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet)