Estudio de la corrosión
1. Objetivos:
Estudiar la corrosión producida en el hierro una vez sometido a diferentes reactivos químicos oxidantes del hierro.
2. Fundamento:
Se suele limitar el concepto "corrosión" a la destrucción química o electroquímica de los metales.
En realidad es difícil dar una definición exacta de corrosión.
Se incluyen a continuación algunas de estas definiciones:
"La corrosión puede ser definida como la reacción de un material con su entorno"
"La corrosión consiste en una oxidación del metal y, si el óxido no es adherente y es poroso, puede dar lugar a la destrucción de todo el metal"
"Corrosión: ataque de un material por el medio que le rodea con la consiguiente pérdida de masa y deterioro de sus propiedades"
"Corrosión es la destrucción de un cuerpo sólido causada por un ataque no provocado, de naturaleza química o electroquímica que se inicia en la superficie"
Esta última es la definición más generalmente aceptada, originaria del "Reichanschuss für Metallschutz". En cualquier caso, la corrosión es un proceso destructivo en lo que a ingeniería se refiere, y representa una enorme pérdida económica.
La corrosión de los metales también puede ser considerada como el proceso inverso de la metalurgia extractiva. Muchos metales existe en la naturaleza en estado combinado, por ejemplo, como óxidos, sulfatos, carbonatos o silicatos. En estos estados, las energías de los metales son más bajas. En el estado metálico las energías de los metales son más altas, y por eso, hay una tendencia espontánea de los metales a reaccionar químicamente para formar compuestos.
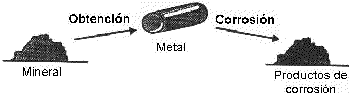
Semejanza entre obtención y corrosión de los metales.
Efectos de la corrosión
El efecto de la corrosión es, en el peor de los casos, la destrucción total de un componente, pero también da lugar a otros problemas, que por menos contundentes no dejan de ser perjudiciales y, en algunos casos, peligrosos para la seguridad de las personas. Por citar algunos se podría hablar de inicios de fractura, fugas en tanques o conducciones, merma de resistencia mecánica en estructuras o en partes de máquina, desviaciones del funcionamiento normal de equipos, contaminación debida a las sustancias que se producen en la corrosión y perjuicio en el aspecto estético.
Desde el punto de vista económico se distinguen dos tipos de pérdidas debidas a la corrosión, las directas y las indirectas.
Tipos de corrosión
Se pueden distinguir entre dos tipos básicos de corrosión: La corrosión generalizada o corrosión uniforme y la corrosión localizada.
La corrosión generalizada afecta más o menos por igual a todos los puntos de la pieza. La corrosión general solo se observa en puntos concretos. En general, la localizada supone pérdidas pequeñas de material, pero sus consecuencias son peores.
La corrosión general permite un mayor seguimiento y previsión, ya que la corrosión localizada es menos previsible y su evolución es mucho menos regular.
Electroquímica:
Aunque el aire atmosférico es el medio más común, las soluciones acuosas son los ambientes que con mayor frecuencia se asocian a los problemas de corrosión. En el término solución acuosa se incluyen aguas naturales, suelos, humedad atmosférica, lluvia y soluciones creadas por el hombre. Debido a la conductividad iónica de estos medios, el ataque corrosivo es generalmente electroquímico.
La definición más aceptada en la bibliografía alemana, elaborada por Lange, entiende por corrosión electroquímica "el paso de electrones e iones de una fase a otra limítrofe constituyendo un fenómeno electrónico, es decir, transformaciones materiales con la cooperación fundamental, activa o pasiva, de un campo eléctrico macroscópico, entendiéndose por macroscópico aquel campo eléctrico que tiene dimensiones superiores a las atómicas en dos direcciones del espacio".
Conforme a la teoría de Lange, en los procesos de corrosión electroquímica de los metales se tiene simultáneamente un paso de electrones libres entre los espacios anódicos y catódicos vecinos, separados entre sí, según el esquema siguiente:
Fenómeno anódico: Ed1 ⇌ Ec1 + n·e¯
Fenómeno catódico: Ec2 + n·e¯ ⇌ Ed2
Lo que entraña una corriente electrónica a través de la superficie límite de las fases. En el proceso anódico, el dador de electrones, Ed1, los cede a un potencial galvánico más negativo, y dichos electrones son captados en el proceso catódico por un aceptor de electrones, Ec2, con potencial más positivo
Uniforme:
La corrosión uniforme puede ser descrita como una reacción de corrosión que ocurre por igual en toda la superficie del material, causando un pérdida general del metal.
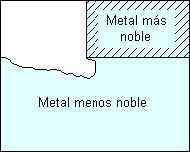
Galvánica:
Definición:
Corrosión acelerada que puede ocurrir cuando metales distintos (con distinto par redox) se unen eléctricamente en presencia de un electrolito (por ejemplo, una solución conductiva).
El ataque galvánico puede ser uniforme o localizado en la unión entre aleaciones, dependiendo de las condiciones. La corrosión galvánica puede ser particularmente severa cuando las películas protectoras de corrosión no se forman o son eliminadas por erosión
Por picadura (Pitting):
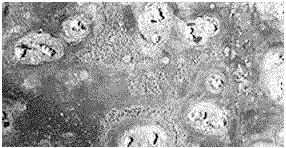
La corrosión por picadura es un tipo de corrosión altamente localizada que frecuentemente se observa en superficies con poca o ninguna corrosión general.
Las picaduras ocurren como un proceso de disolución local anódica donde la pérdida de metal es aumentada por la presencia de un ánodo pequeño y un cátodo grande. Las picaduras suelen ser de pequeño diámetro (décimas de milímetro).
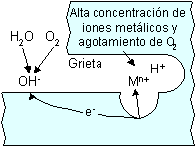
Por fisuras:
Alrededor del hueco formado por contacto con otra pieza de metal igual o diferente a la primera o con un elemento no metálico.
El proceso de pitting y el crevice tienen en común que el agresivo químico está semiestancado, situación de ánodo localizado.
Erosión:
La corrosión por erosión está causada o acelerada por el movimiento relativo de la superficie de metal y el medio. Se caracteriza por rascaduras en la superficie paralelas al movimiento.
La erosión suele prevalecer en aleaciones blandas (por ejemplo, aleaciones de cobre, aluminio y plomo).
Las aleaciones que forman una capa pasivante muestran una velocidad limite por encima de la cual la erosión aumenta rápidamente. Otros factores como turbulencia, cavitación, o efectos galvánicos pueden aumentar la severidad del ataque.
Intergranular:
La corrosión intergranular se refiere a la corrosión selectiva de los límites de grano en metales y aleaciones.
Los límites de grano son zonas de alta energía debido a la gran proporción de dislocaciones en la estructura natural del material.
Este ataque es muy común en algunos aceros inoxidables y aleaciones de níquel.
Exfoliación:
Corrosión en los límites de grano paralelos a la superficie del metal donde los productos de corrosión separan el metal. También llamada corrosión laminar.
Corrosión bajo tensión:
Ataque de un material por la acción conjunta de dos causas: química (agresivo químico) y física (tensión mecánica). Por separado, ninguna ataca al material.
La progresión de la corrosión bajo tensión es de tipo arbóreo. Sigue los límites de los cristales (corrosión por límite de grano o corrosión intergranular).
Por fatiga:
Producida por la unión de una tensión cíclica y de un agente corrosivo. El ataque es transgranular (rotura recta).
Corrosión por rozamiento:
El ataque ocurre cuando dos piezas de metal se deslizan un encima del otro y causan daños mecánicos a uno o a los dos elementos.
En algunos casos, el calor de fricción oxida el metal y su óxido se elimina. En otros casos, la eliminación mecánica de la capa pasivante expone la superficie limpia del metal a los ataques corrosivos.
Ataque por hidrógeno:
A temperaturas elevadas y presión parcial de hidrógeno alta, hidrógeno penetra el acero al carbono, reaccionando con el carbón del acero para formar metano. La presión generada causa una pérdida de ductilidad (fragilización por hidrógeno, "hydrogen embrittlement") y fallos por rotura o formación de burbujas en el acero. La eliminación de carbono del acero (descarburización) provoca el descenso de la resistencia del acero.
- Pérdida selectiva:
Es el proceso donde un elemento específico es eliminado de una aleación debido a una interacción electroquímica con el medio. La descincación de aleaciones de latón es el ejemplo más común de este tipo de corrosión. Suele ocurrir cuando el metal es expuesto a aguas blandas y puede ser acelerada por concentraciones altas de dióxido de carbono y la presencia de iones cloruro.
La corrosión no se puede evitar, tan solo disminuir y prevenir.
Los avances científicos han producido muchos materiales resistentes a la corrosión dependiendo del producto con el cual esté en contacto. Algunos de los factores que influyen en la corrosión son:
- pH de la solución: se estudia el la velocidad de corrosión dependiendo del pH de la solución y del material que del cual esté fabricado el componente.
- Agentes oxidantes: La mayor parte de la corrosión observada en la práctica se da en condiciones en que la oxidación del hidrógeno para dar agua es una parte necesaria del proceso de corrosión. Por esta razón los agentes oxidantes son con frecuencia potentes aceleradores del proceso de corrosión. Aunque pueden acelerar la corrosión de unos materiales, pueden en cambio retardar la que se produzca en otros mediante formación de óxidos en superficie o absorción de capas de oxígeno que las hacen resistentes a los ataques químicos.
- Temperatura: La velocidad de corrosión tiende a aumentar si aumente la tª.
Con el fin de combatir la corrosión se ha de hacer una buena selección de materiales.
Este factor es en el primero en el cual se piensa ya que se ha de elegir un material económico y que cumpla todos los requisitos del proceso.
La mayoría de los metales y en particular el Fe al exponerse al aire o al agua se corroen.
Este fenómeno se explica considerando en el metal pequeñas partes formadas por metal de base y pequeñas impurezas o en caso de un metal puro, ha de tener partes químicamente activas, por haber estado expuesto a esfuerzos de tensión compresión etc.
El proceso de corrosión tiene lugar en ambientes especiales (lugares húmedos) o bien cuando existen diferencias de potencial.
En este informe estudiaremos la corrosión del hierro exponiéndolo a diferentes productos químicos y estudiando posteriormente la corrosión que se ha producido en cada caso si es que se ha llegado a producir.
Cuando se produce un proceso de oxidación con el hierro podemos obtener dos diferentes tipos de productos (óxidos) dependiendo de si se el hierro se ha oxidado a Fe (II) o a Fe(III).
Relación de los diferentes productos resultantes de la oxidación del hierro y sus respectivos colores:
Fe (II): ∘ Fe(OH)2 ⟶ verde ∘ FeO ⟶ negro ∘ Fe2C2O4 ⟶ amarillo ∘ FeCO3 ⟶ verde ∘ Fe2(CN)6Fe ⟶ blanco ∘ Fe4[Fe(CN)6]3 ⟶ azul ∘ SFe ⟶ negro | Fe (III): ∘ Fe2O3 ⟶ rojo ∘ Fe(OH)3 ⟶ pardo ∘ Ac2Fe(OH) ⟶ pardo ∘ Fe4[Fe(CN)6]3 ⟶ azul ∘ FePO4 ⟶ amarillo |
3. Materiales y reactivos:
• 15 tubos de ensayo de vidrio
• 1 gradilla
• 15 puntas de hierro
• Papel indicador de pH
• Solución de ferricianuro potásico (0,1M)
• Soluciones diluidas de:
1) NaOH
2) Na2Cr2O7
3) NaCl
4) HCl
5) KOH
6) Na2CO3
7) HNO3
8) Na3PO4
9) Na2C2O4
10) NaSCN
11) H2SO4
12) KNO3
13) Agua del grifo
14) Agua desionizada
15) Agua del grifo hervida previamente
4. Riesgos previsibles:
Obligatorio el uso de gafas protectoras dado que en esta práctica se van a utilizar productos químicos corrosivos que pueden provocar lesiones en los ojos si se producen salpicaduras.
El hidróxido sódico y potásico irritan la piel y los ojos. El ácido clorhídrico irrita los ojos, a piel y las vías respiratorias. En caso de contacto con los ojos lavar los con agua y acudir urgentemente al médico.
El ácido nítrico provoca quemaduras, en caso de contacto con ojos, lavar con agua y dirigirse a un centro médico rápidamente.
El oxalato sódico es nocivo por contacto con la piel o ingestión, por eso se ha de evitar cualquier contacto con ojos y piel.
El tiocianato es nocivo por ingestión, inhalación y por contacto con la piel. En contacto con ácidos se liberan gases muy tóxicos. Ha de mantenerse lejos de alimentos, bebidas o piensos.
El ácido sulfúrico diluido irrita los ojos y la piel, en caso de contacto con los ojos, lavar abundantemente con agua y acudir inmediatamente al médico.
El nitrato potásico puede provocar incendios con materiales combustibles por eso debe protegerse de fuentes de ignición y no fumar. En caso de incendio o explosión no respirar los homos producidos.
5. Procedimiento:
- Colocar en 15 tubos de ensayo, respectivamente 5 ml de las disoluciones diluidas especificadas en el apartado 3
- Numerar los tubos y anotar la solución que hay en cada tubo
- Medir el pH de cada tubo con un papel indicador
- Sumergir 15 clavos en HCl diluido durante unos minutos, seguidamente lavar con agua destilada y secar
- Introducir un calvo en cada tubo haciéndolo deslizar por las paredes del tubo (manteniéndolo inclinado)
- Dejar reposar los tubos al menos 24 h
- Medir el pH de cada disolución
6. Cálculos, gráficos, expresión de resultados:
Tabla de resultados:
| n° tubo | Solución | pH inicial | pH final | Aspecto final disolución | Precipitado | Color con ferrocianuro | Catión de Fe que reacciona |
| 1 | NaOH | 14 | 14 | Igual | No | Amarillo | III |
| 2 | K2Cr2O7 | 5 | 6 | Amarillo | No | Naranja | III |
| 3 | NaCl | 7 | 7 | Pardo | Si | Verde | II |
| 4 | HCl | 1 | 1 | Igual | Si | Azul | II |
| 5 | KOH | 14 | 14 | Amarillo pálido | No | Amarillo | III |
| 6 | Na2CO3 | 11 | 11 | Amarillo pálido | No | Amarillo | III |
| 7 | HNO3 | 1 | 1 | Negro rojizo | Si | Azul | II |
| 8 | Na3PO4 | 12 | 10 | Igual | No | Amarillo | III |
| 9 | Na2C2O4 | 8 | 8 | Amarillo | Si | Amarillo | III |
| 10 | NaSCN | 8 | 8 | Pardo | Si | Amarillo pardo | III |
| 11 | H2SO4 | 1 | 1 | Azulado | Si | Azul | II |
| 12 | KNO3 | 8 | 8 | Marrón | Si | Azul | II |
| 13 | Agua grifo | 8 | 8 | Marrón | Si | Amarillo | II |
| 14 | Agua desionizada | 8 | 8 | Marrón | Si | Azul | II |
| 15 | Agua herbida | 8 | 8 | Marrón | Si | Amarillo | II |
El hecho de que el ferrocianuro vire a un color azul o verde, depende de si existe presencia de Fe (II) en la disolución, el precipitado será un compuesto formado por Fe (II) y otros componentes de la disolución.
Algunas reacciones producidas en los tubos:
| n° tubo | Reacción |
| 1 | NaOH + Fe+3 ⟶ Fe(OH)3 + Na+ |
| 2 | K2Cr2O7 + Fe+2 ⟶ Cr2O7= + Fe+2 |
| 3 | NaCl + Fe+2 ⟶ FeCl2 + Na+ |
| 4 | HCl + Fe+2 ⟶ FeCl2 + Na+ |
| 5 | KOH + Fe ⟶ Fe(OH)K |
| 6 | Na2CO3 + Fe+2 ⟶ FeCO3 |
| 10 | NaSCN + Fe° ⟶ Fe(SCN)6³¯ |
7. Tratamiento de residuos:
Los clavos pueden lavarse y una vez secos guardarse de nuevo para reutilizar.
Filtrar el contenido de los tubos en los cuales haya aparecido un precipitado, el filtro con el sólido puede tirarse a la basura. Las aguas madres se podrán tirar por la pica con abundante agua una vez neutralizadas
8. Conclusiones:
En esta práctica se ha hecho un estudio de la corrosión del hierro, para intentar determinar cuando utilizaríamos en un caso real este material para conducciones.
Dado que la corrosión es un factor muy importante en la industria que puede provocar graves daños estructurales con las consecuencias económicas que esto implica, los estudio de corrosión son una herramienta importante a la hora de elegir el material con el cual serán fabricados ciertos componentes de la planta química.
El problema de corrosión se da sobretodo en zonas expuestas a agentes corrosivos como pueden ser conducciones o recubrimientos exteriores los cuales, al estar en contacto con la atmósfera se deterioran fácilmente si no se toman medidas.
En el aspecto de los clavos no se ha observado ningún cambio aparente ya que presentaban aspecto oxidado antes del inicio de la práctica, pero en los casos en los que ha habido reacción si se ha podido ver, por la presencia de precipitados.
Con el ferrocianuro potásico se ha podido determinar si el precipitado obtenido era correspondiente a un compuesto de Fe(II) o Fe (III), se pasa de color amarillo a verde o azul se puede decir que el precipitado es de Fe (II) puesto que el ferrocianuro reacciona con este catión dando ese color característico.
En principio nunca se utilizarían conducciones de hierro para pasar a través de ellas disoluciones que puedan reaccionar de una o otra manera con él.
Esto se puede apreciar en las disoluciones que presentan precipitados, se han producido al reaccionar con el Fe° del clavo originando un compuesto procedente de una oxidación, de Fe (II) o Fe (III) dependiendo del caso.
En general los compuestos ácidos y los que llevan Cl oxidan el hierro, por eso el agua de mar es tan corrosiva con los metales, debido a la alta concentración de NaCl que tiene.
Un factor importante que provoca el aumento de la corrosión es la temperatura, un compuesto muy corrosivo lo será mucho más a una temperatura elevada que a temperatura ambiente.
Un dato que llama la atención es que el agua desionizada sea corrosiva con el hierro, teóricamente esto no es posible ya que ha sido tratada con resinas especiales que quitan el contenido de cationes y aniones (Cl¯, CO3= …) que presenta el agua del grifo.
El hierro podría ser un buen material para construir conducciones en el caso de que los productos que transportara fueran hidróxidos, carbonatos etc …
Bibliografía:
- López, V. "Técnicas de laboratorio"; ed Edunsa; 2ª edición, Octubre 1.994
- Costa, J.; et al "Curso de ingenieria química" ed. Reverté; 1.994
- "Seguridad en Laboratorios químicos", Panreac
- Perry; "Manual del Ingeniero Químico"; ed. McGraw-Hill; 6ª edición (1.998)
Autor: Alex. España.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet)