Introducción a la Biología (Parte I)
La materia, desde la partícula más pequeña al organismo más complejo, está constituida por elementos y combinaciones de estos. En la Tierra, existen unos 92 elementos. Algunos son muy conocidos, como el carbono, que se encuentra en forma pura en el diamante y en el grafito; el oxígeno, abundante en el aire que respiramos; el calcio, utilizado por muchos organismos para construir conchas, cáscaras de huevo, huesos y dientes, y el hierro, que es el metal responsable del color rojo de nuestra sangre. La partícula más pequeña de un elemento es el átomo. Estos, a su vez, están constituidos por partículas más pequeñas: protones, neutrones y electrones.
Actualmente la estructura del átomo es explicada por medio del modelo orbital. Los átomos son las piezas fundamentales de toda la materia viva y no viva. Aun así, son muy pequeños y constituyen un espacio eminentemente vacío. Los electrones se mueven alrededor del núcleo a una gran velocidad -una fracción de la velocidad de la luz- siendo la distancia entre el electrón y el núcleo, en promedio, unas 1.000 veces el diámetro del núcleo.
En un átomo, existe una íntima relación entre los electrones y la energía. En un modelo simplificado, la distancia de un electrón al núcleo está determinada por la cantidad de energía potencial -o "energía de posición"- que posee el electrón. Así, los electrones tienen diferentes cantidades de energía de acuerdo a su ubicación con respecto al núcleo y, a su vez, su número y distribución determina el comportamiento químico de un átomo.
Las partículas formadas por dos o más átomos se conocen como moléculas que se mantienen juntas por medio de enlaces químicos.
Las reacciones químicas involucran el intercambio de electrones entre los átomos y pueden representarse con ecuaciones químicas. Tres tipos generales de reacciones químicas son:
a) La combinación de dos o más sustancias para formar una sustancia diferente
b) La disociación de una sustancia en dos o más
c) El intercambio de átomos entre dos o más sustancias
Las sustancias formadas por átomos de dos o más elementos diferentes, en proporciones definidas y constantes, se conocen como compuestos químicos.
En los seres vivos la materia se ordena en los llamados niveles de organización biológica. Cada nivel, desde el subatómico hasta el de la biosfera, tiene propiedades particulares -o emergentes- que surgen de la interacción entre sus componentes.
Átomos
El núcleo de un átomo contiene protones cargados positivamente y -a excepción del hidrógeno, (1H)- neutrones, que no tienen carga. El número atómico es igual al número de protones en el núcleo de un átomo. El peso atómico de un átomo es, aproximadamente, la suma del número de protones y neutrones existentes en su núcleo. Las propiedades químicas de un átomo están determinadas por sus electrones, que son partículas pequeñas y cargadas negativamente, que se encuentran fuera del núcleo. El número de electrones en un átomo es igual al número de protones, esto determina su número atómico.
Todos los átomos de un elemento determinado tienen el mismo número de protones en su núcleo. En algunas ocasiones, sin embargo, diferentes átomos del mismo elemento contienen diferentes números de neutrones. Estos átomos que, por lo tanto, difieren entre sí en sus pesos atómicos, pero no en sus números atómicos, se conocen como isótopos del elemento.
La mayoría de los elementos tienen varias formas isotópicas. Si bien, no todos, muchos de los isótopos menos comunes son radiactivos. Esto significa que el núcleo del átomo es inestable y emite energía cuando cambia a una forma más estable. La energía liberada por el núcleo de un isótopo radiactivo puede estar en forma de partículas subatómicas que se mueven rápidamente, de radiación electromagnética o en ambas formas. Pueden detectarse con un contador Geiger o con una película fotográfica.
Estructura atómica de ciertos elementos familiares
| Elemento | Símbolo | Núcleo | N° de electrones | |
|---|---|---|---|---|
| N° de protones | N° de neutrones* | |||
| Hidrógeno | H | 1 | 0 | 1 |
| Helio | He | 2 | 2 | 2 |
| Carbono | C | 6 | 6 | 6 |
| Nitrógeno | N | 7 | 7 | 7 |
| Oxígeno | O | 8 | 8 | 8 |
| Sodio | Na | 11 | 12 | 11 |
| Fósforo | P | 15 | 16 | 15 |
| Azufre | S | 16 | 16 | 16 |
| Cloro | Cl | 17 | 18 | 17 |
| Potasio | K | 19 | 20 | 19 |
| Calcio | Ca | 20 | 20 | 20 |
Electrones y energía
Los electrones más próximos al núcleo tienen menos energía que los más alejados y, de esta manera, se encuentran en un nivel energético más bajo. Un electrón tiende a ocupar el nivel energético más bajo disponible, pero con el ingreso de energía puede ser lanzado a un nivel energético más alto. Cuando el electrón regresa a un nivel de energía más bajo, se libera energía, en forma de onda, ésta puede ser luz, calor o radiación.
En un modelo simplificado, la distancia de un electrón al núcleo está determinada por la cantidad de energía potencial (llamada frecuentemente "energía de posición") que posee el electrón.
La siguiente analogía puede ser útil. Una roca que descansa en un terreno plano no gana ni pierde energía potencial. La energía usada para empujar la roca hasta la cima de una colina se transforma en energía potencial, almacenada en la roca cuando reposa en la cima de la colina. Esta energía potencial se convierte en energía cinética (o energía de movimiento) cuando la roca rueda cuesta abajo. Parte de la energía se pierde en forma de energía térmica, producida por la fricción entre la roca y la colina.
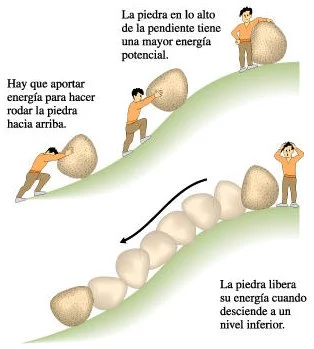
Cuando un átomo recibe una cantidad de energía, un electrón puede ser lanzado a un nivel energético más alto. Así, el electrón gana energía potencial, que se libera cuando retorna a su nivel energético anterior.
Un átomo es más estable cuando todos sus electrones se encuentran en sus niveles de energía más bajos posibles, llamado estado basal, y esos niveles de energía están completos. El primer nivel energético puede tener dos electrones, el segundo puede tener ocho, y éste es el mismo número que tiene el tercer nivel de energía de los átomos de mayor interés en biología. Las reacciones químicas entre los átomos resultan de su tendencia a alcanzar la distribución electrónica más estable posible.
Bibliografía:
- Apuntes de clase - Facultad de Agronomía - U.B.A
- Silvia R. Leicach. "Biomoléculas: estructura y rol metabólico". Segunda edición
- Helena Curtis - N. Sue Barnes. "Biología". Sexta edición en español
Autor: Diana Victoria Netto. Ingeniera Agrónoma. Argentina.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).
- ‹ Anterior
- |
- Siguiente ›