Propiedades del agua y su importancia (Parte II)
El agua como solvente
Dentro de los sistemas vivos, muchas sustancias se encuentran en solución acuosa. Una solución es una mezcla uniforme de moléculas de dos o más sustancias. La sustancia presente en mayor cantidad, que es habitualmente líquida, se llama solvente, y las sustancias presentes en cantidades menores se llaman solutos. La polaridad de las moléculas de agua es la responsable de la capacidad solvente del agua. Las moléculas polares de agua tienden a separar sustancias iónicas, como el cloruro de sodio (NaCl), en sus iones constituyentes. Las moléculas de agua se aglomeran alrededor de los iones con carga y los separan unos de otros.
Este diagrama muestra al cloruro de sodio (NaCl) disolviéndose en el agua a medida que las moléculas de ésta se aglomeran alrededor de los iones individuales sodio y cloruro separándolos unos de otros. Nótese la diferencia entre el modo en que las moléculas de agua están dispuestas alrededor de los iones sodio y la manera en que se disponen alrededor de los iones cloruro.
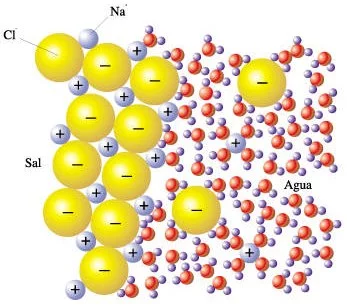
Dada la polaridad de sus moléculas, el agua puede servir como disolvente para sustancias iónicas y moléculas polares.
Muchas de las moléculas importantes en los sistemas vivos que presentan uniones covalentes, como los azúcares, tienen regiones de carga parcial positiva o negativa. Estas moléculas, por lo tanto, atraen moléculas de agua y también se disuelven en agua. Las moléculas polares que se disuelven rápidamente en agua son llamadas hidrofílicas ("que aman al agua''). Estas moléculas se disuelven fácilmente en agua porque sus regiones parcialmente cargadas atraen moléculas de agua tanto o más que lo que se atraen entre sí. Las moléculas polares de agua compiten de este modo con la atracción existente entre las moléculas de soluto.
Moléculas tales como las grasas, que carecen de regiones polares, tienden a ser muy insolubles en el agua. Los puentes de hidrógeno entre las moléculas de agua actúan como una fuerza que excluye a las moléculas no polares. Como resultado de ésta exclusión, las moléculas no polares tienden a agruparse en el agua, al igual que las gotitas de grasa tienden a juntarse, por ejemplo, en la superficie del caldo de gallina. Dichas moléculas son llamadas hidrofóbicas ("que tienen aversión por el agua") y los agrupamientos se producen por interacciones hidrofóbicas.
Ionización del agua: ácidos y bases
En el agua líquida hay una leve tendencia a que un átomo de hidrógeno salte del átomo de oxígeno al que está unido covalentemente, al otro átomo de oxígeno al que se encuentra unido por un puente de hidrógeno. En ésta reacción se producen dos iones: el ion hidronio (H₃O⁺) y el ion hidróxido (OH⁻). En cualquier volumen dado de agua pura se encuentra ionizado de esta forma un número pequeño, pero constante, de moléculas de agua. El número es constante porque la tendencia del agua a ionizarse se contrapesa con la tendencia de los iones a reunirse. Así, aunque algunas moléculas están ionizándose, un número igual de otras moléculas está formándose; este estado se conoce como equilibrio dinámico.
Cuando el agua se ioniza, un núcleo de hidrógeno (o sea, un protón) se desplaza del átomo de oxígeno al cual se encuentra unido covalentemente, al átomo de oxígeno con el que establece un puente de hidrógeno. Los iones resultantes son el ion hidróxido cargado negativamente y el ion hidronio cargado positivamente. En este diagrama, las esferas grandes representan al oxígeno y las pequeñas al hidrógeno.
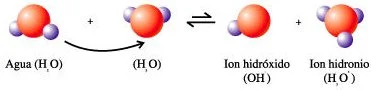
Ionización del agua.
En el agua pura, el número de iones H⁺ iguala exactamente al número de iones OH⁻ ya que ningún ion puede formarse sin el otro cuando solamente hay moléculas de H₂O presentes. Sin embargo, cuando una sustancia iónica o una sustancia con moléculas polares se disuelve en el agua, pueden cambiar los números relativos de los iones H⁺ y OH⁻.
Por ejemplo, cuando el ácido clorhídrico (HCl) se disuelve en agua, se ioniza casi completamente en iones H⁺ y Cl-; como resultado de esto, una solución de HCl (ácido clorhídrico) contiene más iones H⁺ que OH⁻. De modo inverso, cuando el hidróxido de sodio (NaOH) se disuelve en agua, forma iones Na⁺ y OH⁻; así, en una solución de hidróxido de sodio en agua hay más iones OH⁻ que H⁺.
Una solución es ácida cuando el número de iones H⁺ supera al número de iones OH⁻, de modo contrario, una solución es básica -o alcalina- cuando el número de iones OH⁻ supera al número de iones H⁺. Así, un ácido es una sustancia que provoca un incremento en el número relativo de iones H⁺ en una solución, y una base es una sustancia que provoca un incremento en el número relativo de iones OH⁻.
Los ácidos y bases fuertes son sustancias, tales como el HCl y el NaOH, que se ionizan casi completamente en agua, dando como resultado incrementos relativamente grandes en las concentraciones de iones H⁺ y OH⁻, respectivamente. Los ácidos y bases débiles, por contraste, son aquellos que se ionizan sólo ligeramente, dando como resultado incrementos relativamente pequeños en la concentración de iones H⁺ u OH⁻.
Dada la fuerte tendencia de los iones H⁺ y OH⁻ a combinarse y la débil tendencia del agua a ionizarse, la concentración de los iones OH⁻ disminuirá siempre a medida que la concentración de los iones H⁺ se incremente (como, por ejemplo, cuando se añade HCl al agua), y viceversa. En otras palabras, si un ácido y una base de fuerzas comparables se añaden en cantidades equivalentes, la solución no tendrá un exceso ni de iones H⁺ ni de OH⁻.
Muchos de los ácidos importantes en los sistemas vivos deben sus propiedades ácidas a un grupo de átomos llamado grupo carboxilo, que incluye un átomo de carbono, dos átomos de oxígeno y un átomo de hidrógeno (simbolizado como —COOH). Cuando se disuelve en agua una sustancia que contiene un grupo carboxilo, algunos de los grupos —COOH se disocian y producen iones hidrógeno. Así, los compuestos que contienen grupos carboxilo son dadores de iones hidrógeno, o ácidos. Son ácidos débiles, sin embargo, porque el grupo —COOH se ioniza sólo levemente.
Entre las bases más importantes de los sistemas vivos se encuentran los compuestos que contienen al grupo amino (-NH₂). Este grupo tiene una tendencia débil a aceptar iones hidrógeno, formando, por lo tanto, el grupo -NH₃+. En tanto los iones hidrógeno son eliminados de la solución por el grupo amino, la concentración relativa de los iones H⁺ disminuye y la concentración relativa de los iones OH⁻ aumenta. Grupos, tales como el -NH₂, que son aceptores débiles de iones hidrógeno son, así, bases débiles.
Los químicos expresan el grado de acidez por medio de la escala de pH. El símbolo pH indica el logaritmo negativo de la concentración de iones hidrógeno en unidades de moles por litro. Los números cuyos logaritmos son de interés para nosotros son las concentraciones de iones hidrógeno en las soluciones, que se expresan en moles por litro.
La ionización que ocurre en un litro de agua pura da como resultado la formación, en el equilibrio, de 1/10.000.000 de mol de iones hidrógeno (y, como hemos notado previamente, exactamente la misma cantidad de iones hidróxido). En forma decimal, ésta concentración de iones hidrógeno se escribe como 0,0000001 mol por litro o, en forma exponencial, como 10⁻⁷ mol por litro. El logaritmo es el exponente -7 y el logaritmo negativo es 7; con referencia a la escala de pH, se lo menciona simplemente como pH 7. A pH 7 las concentraciones de H⁺ y OH⁻ libres son exactamente iguales dado que están en agua pura. Este es un estado neutro. Cualquier pH por debajo de 7 es ácido y cualquier pH por encima de 7 es básico. Cuanto menor sea el valor del pH, mayor será la concentración de iones hidrógeno. Dado que la escala de pH es logarítmica, una diferencia en una unidad de pH implica una diferencia de 10 veces en la concentración de iones hidrógeno. Por ejemplo, una solución de pH 3 tiene 1.000 veces más iones H⁺ que una solución de pH 6.
Una diferencia de una unidad de pH refleja una diferencia de 10 veces en la concentración de iones H⁺. Las bebidas cola, por ejemplo, son 10 veces más ácidas que el jugo de tomate. Los jugos gástricos son 100 veces más ácidos que las bebidas cola.
Casi toda la química de los seres vivos tiene lugar a pH entre 6 y 8. Como excepciones notables podemos mencionar los procesos químicos en el estómago de los humanos y otros animales, que tienen lugar a pH de aproximadamente 2. La sangre humana, por ejemplo, mantiene un pH casi constante de 7,4, a pesar del hecho de que es el vehículo de gran número y variedad de nutrientes y otros compuestos químicos que reparte entre las células, así como de la eliminación de desechos, muchos de los cuales son ácidos y bases.
El mantenimiento de un pH constante, un ejemplo de homeostasis, es importante porque el pH influye en gran medida en la velocidad de las reacciones químicas. Los organismos resisten cambios fuertes y repentinos en el pH de la sangre y otros fluidos corporales por medio de amortiguadores o buffers, que son combinaciones de formas dadoras de H⁺ y aceptoras de H⁺ de ácidos o bases débiles.
Los buffers mantienen el pH constante por su tendencia a combinarse con iones H⁺, eliminándolos así de la solución cuando la concentración de iones H⁺ comienza a elevarse y liberándolos cuando desciende. En los sistemas vivos funciona una gran variedad de buffers, siendo cada uno de ellos más efectivo al pH particular en el que las concentraciones del dador y del aceptor de H⁺ son iguales.
Bibliografía:
- Apuntes de clase - Facultad de Agronomía - U.B.A
- Silvia R. Leicach. "Biomoléculas: estructura y rol metabólico". Segunda edición
- Helena Curtis - N. Sue Barnes. "Biología". Sexta edición en español
Autor: Diana Victoria Netto. Ingeniera Agrónoma. Argentina.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).
- ‹ Anterior
- |
- Siguiente ›