Reacciones de óxido-reducción
Los electrones poseen diferentes cantidades de energía potencial dependiendo de su distancia al núcleo del átomo y de la atracción ejercida por el núcleo sobre ellos. Un ingreso de energía lanzará a un electrón a un nivel energético más alto, pero si no se añade energía, el electrón permanecerá en el nivel energético más bajo que encuentre disponible.
Las reacciones químicas son, transformaciones de energía en virtud de las cuales la energía almacenada en los enlaces químicos se transfiere a otros enlaces químicos recién formados. En estas transferencias, los electrones se desplazan de un nivel de energía a otro. En muchas reacciones, los electrones pasan de un átomo o molécula a otro, son de gran importancia en los sistemas vivos, y se conocen como reacciones de óxido-reducción -o redox-. La pérdida de un electrón se denomina oxidación y el átomo o molécula que pierde el electrón se dice que se ha oxidado. La razón de que la pérdida de electrones se conozca como oxidación es que el oxígeno, que atrae muy fuertemente a los electrones, es el que por lo general actúa como aceptor de electrones.
La reducción es, por el contrario, la ganancia de un electrón. La oxidación y la reducción siempre ocurren simultáneamente, porque el electrón que pierde el átomo oxidado es aceptado por otro átomo que se reduce en el proceso. En las reacciones de oxidación-reducción se produce un movimiento de electrones de un átomo a otro. Un átomo o molécula que pierde electrones se oxida; el que los gana se reduce.
Ejemplos de reacciones:
a) La oxidación del sodio y la reducción del cloro
b) Otra reacción de oxidación-reducción; oxidación parcial del metano (CH₄)
En algunas reacciones de oxidación-reducción, como la oxidación del sodio y la reducción del cloro, se transfiere únicamente un electrón de un átomo a otro. Estas simples reacciones son típicas de los elementos o de las moléculas inorgánicas.
En otras reacciones de oxidación-reducción, como ésta oxidación parcial del metano (CH₄), electrones y protones van juntos, éstas son reacciones organicas. En éstas reacciones la oxidación es la pérdida de átomos de hidrógeno y la reducción es la ganancia de átomos de hidrógeno. Cuando un átomo de oxígeno gana dos átomos de hidrógeno, como se muestra en la figura, evidentemente el producto es una molécula de agua.
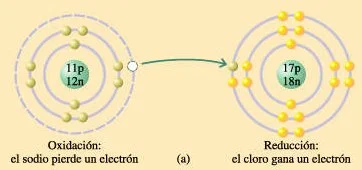
La oxidación del sodio y la reducción del cloro
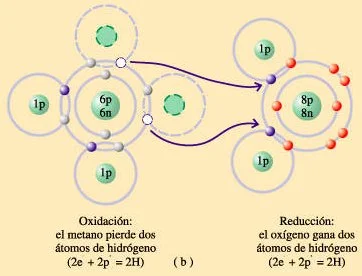
Oxidación parcial del metano (CH₄)
Reacción redox
En los sistemas vivos, las reacciones que capturan energía (fotosíntesis) y las reacciones que liberan energía (glucólisis y respiración), son reacciones de oxidación-reducción. La oxidación completa de un mol de glucosa libera 686 kilocalorías de energía libre; de modo inverso, la reducción del dióxido de carbono para formar un mol de glucosa almacena 686 kilocalorías de energía libre en los enlaces químicos de la glucosa. Si ésta energía fuera liberada de una sola vez, la mayor parte se disiparía como calor. Esto no solamente no sería útil para la célula, sino que la alta temperatura resultante sería letal. Sin embargo, la vida ha evolucionado adquiriendo mecanismos que regulan la marcha de estas reacciones químicas y una multitud de otras, de modo tal que la energía se almacena en enlaces químicos particulares de los que puede ser liberada en pequeñas cantidades cuando la célula lo necesite. Estos mecanismos, con la aparición de nuevos tipos de moléculas, permiten un aprovechamiento eficaz de la energía sin alterar el delicado equilibrio que caracteriza a los sistemas biológicos. Implican generalmente secuencias de reacciones, algunas de las cuales son reacciones de oxidación-reducción. Aunque cada reacción en la secuencia representa solamente un pequeño cambio en la energía libre, el cambio global de energía libre para la secuencia puede ser considerable.
Bibliografía:
- Apuntes de clase - Facultad de Agronomía - U.B.A
- A. Lehninger, D, Nelson y M. Cox. "Principios de bioquímica". Editorial Omega, 2.000
- Helena Curtis - N. Sue Barnes. "Biología". Sexta edición en español
Autor: Diana Victoria Netto. Ingeniera Agrónoma. Argentina.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).