Tipos de gases empleados como combustibles
Introducción
El gas natural es un recurso energético y forma parte del conjunto de medios con los que los países del mundo intentan cubrir sus necesidades de energía. La energía es la base de la civilización industrial; sin ella, la vida moderna dejaría de existir. A largo plazo es posible que las prácticas de conservación de energía proporcionen el tiempo suficiente para explorar nuevas posibilidades tecnológicas.
A lo largo del siglo XX, la mayor comodidad y menores costes del petróleo y el gas hicieron que desplazaran al carbón en la calefacción de viviendas y oficinas y en la propulsión de locomotoras, y en el mercado industrial. Incluso en el mercado de las centrales térmicas el petróleo y el gas fueron reemplazando al carbón, y la contribución del carbón al panorama energético global cayó en picado.
Se denomina combustible gaseoso a cualquier mezcla gaseosa empleada como combustible para proporcionar energía en usos domésticos o industriales. Los combustibles gaseosos están formados principalmente por hidrocarburos. Las propiedades de los diferentes gases dependen del número y disposición de los átomos de carbono e hidrógeno de sus moléculas. Además de sus componentes combustibles, la mayoría de estos gases contienen cantidades variables de nitrógeno y agua.
Los combustibles gaseosos empleados en la actualidad son los siguientes:
- Gas de hulla: Los procesos de gasificación de hulla más importantes están destinados sobre todo a la producción del gas denominado "de tipo gasoducto", cuyas propiedades son más o menos equivalentes a las del gas natural. El gas procedente de la hulla, además de cumplir las especificaciones de bombeo y calentado, debe satisfacer límites estrictos en cuanto al contenido de monóxido de carbono, azufre, gases inertes y agua. Para cumplir estas normas, la mayoría de los procesos de gasificación de hulla culminan con operaciones de limpieza y metanación del gas. En la actualidad se utilizan diversos métodos de hidrogasificación en los que el hidrógeno reacciona directamente con carbón para formar metano; estos procesos evitan el paso intermedio consistente en producir gas de síntesis, hidrógeno y monóxido de carbono antes de producir metano. Otros métodos son el proceso de aceptores de dióxido de carbono, que emplea dolomita, un material calizo, y el proceso de sal fundida. Otros gases fabricados en el pasado a partir de carbón y coque, como el gas del alumbrado o el gas de horno de coque, apenas tienen importancia hoy día
- Gas de alto horno: producido por la interacción de caliza, mineral de hierro y carbono en los altos hornos, tiene un cierto poder calorífico debido a su contenido en monóxido de carbono, pero contiene un 60% de nitrógeno. Durante el funcionamiento de los hornos se producen cantidades enormes de este gas; la mayoría se emplea para calentar el chorro de aire para el horno y hacer funcionar los compresores que impulsan dicho chorro. El poder calorífico del gas de alto horno es un 16% del correspondiente al gas de horno de coque
- Gas natural: extraído de yacimientos subterráneos de gas, y objeto principal de este trabajo
- Gas licuado de petróleo: (GLP), mezcla de gases licuados, sobre todo propano o butano. El GLP se obtiene a partir de gas natural o petróleo. De esta clase nos ocuparemos en brevemente más adelante
Gas Natural
Componentes del gas natural
Los siguientes, son los componentes principales del gas natural, estos varían según el yacimiento:
| Componente | % | Componente | % |
|---|---|---|---|
| Metano | 95,0812 | i-pentano | 0,0152 |
| Etano | 2,1384 | Benceno | 0,0050 |
| Propano | 0,2886 | Ciclohexano | 0,0050 |
| n-butano | 0,0842 | Nitrógeno | 1,9396 |
| i-butano | 0,0326 | CO₂ | 0,3854 |
| n-pentano | 0,0124 | Otros | 0,0124 |
Cuadro 1
Las propiedades del gas natural según la composición indicada en el cuadro 1, son las siguientes:
- Densidad: 0,753 kg/m³
- Poder calorífico: 9,032 kcal/m³
- Cp (presión constante): 8,57 cal/mol·°C
- Cv (volumen constante): 6,56 cal/mol·°C
1. Metano: Llamado gas de los pantanos, hidrocarburo de fórmula CH₄, el primer miembro de la serie de los alcanos. Es más ligero que el aire, incoloro, inodoro e inflamable. Se encuentra en el gas natural, como en el gas grisú de las minas de carbón, en los procesos de las refinerías de petróleo, y como producto de la descomposición de la materia en los pantanos. Es uno de los principales componentes de la atmósfera de los planetas Saturno, Urano y Neptuno.
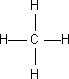
Fórmula desarrollada de la molécula de metano
2. Etano: Gas incoloro e inflamable, hidrocarburo de fórmula C₂H₆, el segundo miembro de la serie de los alcanos.
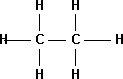
Fórmula desarrollada de la molécula de etano
3. Eteno o Etileno: El eteno es un hidrocarburo de fórmula C₂H₄, el miembro más simple de la clase de compuestos orgánicos llamados alquenos. Es un gas incoloro, con un olor ligeramente dulce, arde con una llama brillante, es ligeramente soluble en agua.
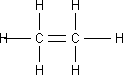
Fórmula desarrollada de la molécula de eteno o etileno
4. Propano: El tercer hidrocarburo de la serie de los alcanos, de fórmula C₃H₈. Gas incoloro e inodoro. Se encuentra en el petróleo en crudo, en el gas natural y como producto derivado del refinado del petróleo. El propano no reacciona vigorosamente a temperatura ambiente, pero, a temperaturas más altas, arde en contacto con el aire.
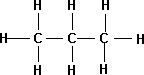
Fórmula desarrollada de la molécula de propano
5. Butano: Cualquiera de los dos hidrocarburos saturados o alcanos, de fórmula química C₄H₁₀, en ambos compuestos, los átomos de carbono se encuentran unidos formando una cadena abierta. En el n-butano (normal), la cadena es contínua y sin ramificaciones, mientras que en el i-butano (iso), o metilpropano, uno de los átomos de carbono forma una ramificación lateral. Esta diferencia de estructura es la causa de las distintas propiedades que presentan. El n-butano y el i-butano están presentes en el gas natural, en el petróleo y en los gases de las refinerías. Poseen una baja reactividad química a temperatura normal, pero arden con facilidad al quemarse en el aire o con oxígeno.
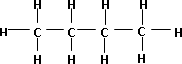
Fórmula desarrollada de la molécula de n-butano
Fórmula desarrollada de la molécula de i-butano
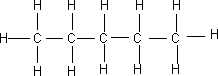
6. Pentano: Quinto miembro de los alcanos alcanos, de fórmula química C₅H₁₂, se presenta con dos configuraciones el n-pentano y el i-pentano.
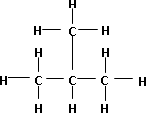
Fórmula desarrollada de la molécula de pentano
7. Benceno: Líquido incoloro de olor característico y sabor a quemado, de fórmula C₆H₆, en estado puro arde con una llama humeante debido a su alto contenido de carbono. Sus vapores son explosivos, y el líquido es violentamente inflamable.
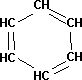
Fórmula desarrollada de la molécula de benceno
8. Ciclohexano: Líquido volátil e incoloro con olor penetrante, de fórmula C₆H₁₂, que acompaña al gas natural.
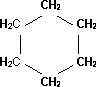
Fórmula desarrollada de la molécula de ciclohexano
Profesores: Arquitecto Costoya. y J. F. Aguirre
Autor: Anselmo Robles Bentham, Ricardo Santiago Netto, Osvaldo Daniel Pumar. Argentina.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).
Indice de octano. Yacimientos. Cuencas gasíferas