Problema nº 6 de potencia eléctrica, consumo eléctrico - TP11
Enunciado del ejercicio nº 6
¿Cuántos faradios de carga deben pasar en CNPT para desprender 22,4 l de:
a) Hidrógeno (H₂).
b) Oxígeno (O₂).
Desarrollo
Datos:
V = 22,4 dm³ = 2,24·10⁻² m³
1 F = 96.500 C
Fórmulas:
![]()
![]()
Solución
a)
Para 22,4 dm³
1 mol
![]()
Reemplazamos por los valores y calculamos:
![]()
ξH = 1,008 g
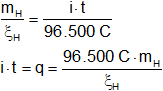
Reemplazamos por los valores y calculamos:
![]()
q = 193.000 C
1 F = 96.500 C
Resultado, la carga en faradios para el hidrógeno es:
193.000 C = 2 F
b)
Para 22,4 dm³
1 mol
![]()
Reemplazamos por los valores y calculamos:
![]()
ξO = 8 g
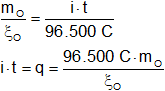
Reemplazamos por los valores y calculamos:
![]()
q = 386.000 C
1 F = 96.500 C
Resultado, la carga en faradios para el oxígeno es:
386.000 C = 4 F
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP11
- | Siguiente ›
Ejemplo, cómo determinar el consumo eléctrico