Aerostática
La aerostática frente a la hidrostática
Desde un punto de vista mecánico, la diferencia fundamental entre líquidos y gases consiste en que estos últimos pueden ser comprimidos. Su volumen, por tanto, no es constante y consiguientemente tampoco lo es su densidad. Teniendo en cuenta el papel fundamental de esta magnitud física en la estática de fluidos, se comprende que el equilibrio de los gases haya de considerarse separadamente del de los líquidos.
Así, la ecuación fundamental de la hidrostática no puede ser aplicada a la aerostática. El principio de Pascal, en el caso de los gases, no permite la construcción de prensas hidráulicas. El principio de Arquímedes conserva su validez para los gases y es el responsable del empuje aerostático, fundamento de la elevación de los globos y aeróstatos. Sin embargo, y debido a la menor densidad de los gases, en iguales condiciones de volumen del cuerpo sumergido, el empuje aerostático es considerablemente menor que el hidrostático.
La compresibilidad de los gases. Ley de Boyle
El volumen del gas contenido en un recipiente se reduce si se aumenta la presión. Esta propiedad que presentan los gases de poder ser comprimidos se conoce como compresibilidad y fue estudiada por el físico inglés Robert Boyle (1.627 - 1.691). Si se dispone de un cilindro con un émbolo móvil que puede modificar el volumen de aquél y se introduce un gas en su interior, el volumen ocupado por el gas variará con la presión del émbolo de tal modo que su producto se mantiene constante si la temperatura es constante durante el experimento. Es decir:
p·V = constante
Ello significa que a temperatura constante la presión y el volumen de un gas son magnitudes inversamente proporcionales.
![]()
Por tanto la representación gráfica de p frente a V corresponde a una hipérbola equilátera. Este resultado se conoce como ley de Boyle y describe de forma aproximada el comportamiento de un gas en un amplio rango de presiones y volúmenes. No obstante, a temperaturas elevadas o a presiones elevadas, para las cuales el gas se aproxima bastante al estado líquido, la ley de Boyle deja de cumplirse con una precisión razonable.
La presión atmosférica
Del mismo modo que existe una presión hidrostática en los líquidos asociada al peso de unas capas de líquido sobre otras, las grandes masas gaseosas pueden dar lugar a presiones considerables debidas a su propio peso. Tal es el caso de la atmósfera. La presión del aire sobre los objetos contenidos en su seno se denomina presión atmosférica.
La ley de variación de la presión atmosférica con la altura es mucho más complicada que la descrita por la ecuación fundamental de la hidrostática p = p₀ + ρ·g·h. Al tratarse de un fluido compresible, la densidad no es constante, sino que varía con la presión; pero además, para variaciones importantes de la altura el valor de g tampoco se mantiene constante. Esta dependencia mutua de las variables que aparecen en la anterior ecuación hace que el cálculo preciso de la presión atmosférica en un punto determinado sea una tarea compleja que proporciona tan sólo resultados aproximados.
La primera comprobación experimental de la existencia de una presión asociada al aire fue efectuada por Evangelista Torricelli (1.608 - 1.647). El experimento de Torricelli consistió en llenar de mercurio un tubo de vidrio de más de un metro de largo, cerrarlo provisionalmente e invertirlo sumergiéndolo en una gran cubeta con mercurio. Cuando abrió el extremo del tubo sumergido observó que éste sólo se vaciaba en parte, quedando en su interior una columna de mercurio de unos setenta y seis centímetros.
Este resultado fue interpretado como una prueba de que la presión del peso del aire actuando sobre la superficie libre del mercurio de la cubeta era capaz de soportar el peso de la columna. En el espacio restante del tubo se había producido el primer vacío de la historia de la física que se conoce como vacío de Torricelli. La presión correspondiente a una columna de mercurio de 760 mm de altura define, precisamente, la atmósfera (atmósfera) como unidad de presión.
Además de con la altura, la presión atmosférica varía con la temperatura y con la humedad y, en general, con el estado del tiempo, por lo que constituye una magnitud decisiva en el análisis y en la predicción meteorológicos. Las primeras variaciones de la presión atmosférica de un día a otro fueron observadas por el propio Torricelli con su dispositivo, que fue precursor de los actuales barómetros.
Manómetros y barómetros
Un manómetro es un aparato que sirve para medir la presión de los gases contenidos en recipientes cerrados. Existen, básicamente, dos tipos de manómetros: los de líquidos y los metálicos. Los manómetros de líquidos emplean, por lo general, mercurio que llena un tubo en forma de J. El tubo puede estar o abierto por ambas ramas o abierto por una sola. En ambos casos la presión se mide conectando al recipiente que contiene el gas el tubo por su rama inferior y abierta y determinando el desnivel h de la columna de mercurio entre ambas ramas. Si el manómetro es de tubo abierto entonces es necesario tomar en cuenta la presión atmosférica p₀ en la ecuación:
p = p₀ ± ρ·g·h
Si es de tubo cerrado, la presión vendrá dada directamente por p = ρ·g·h. Los manómetros de este segundo tipo permiten, por sus características, la medida de presiones elevadas. En los manómetros metálicos la presión del gas da lugar a deformaciones en una cavidad o tubo metálico. Estas deformaciones se transmiten a través de un sistema mecánico a una aguja que marca directamente la presión del gas sobre una escala graduada.
El barómetro es el aparato con el que se mide la presión atmosférica. Como en el caso de los manómetros, los hay también de mercurio y metálicos. Los primeros se basan en el dispositivo utilizado por Torricelli en sus experimentos. El llamado barómetro de fortín es, de hecho, una reproducción mejorada del aparato de Torricelli. Su cubeta posee un fondo compuesto de un material flexible, por lo que puede ser alterado mediante un tornillo auxiliar con el fin de conseguir ajustar el nivel del mercurio de la cubeta al cero de la escala graduada cada vez que se efectúa una medida. Los barómetros de sifón son simples manómetros de tubo cerrado en los cuales la rama corta del tubo en J hace las veces de cubeta y la rama larga de tubo de Torricelli.
Los barómetros metálicos o aneroides constan de una caja metálica de paredes relativamente elásticas, en cuyo interior se ha efectuado el vacío. Un resorte metálico hace que las paredes de la caja estén separadas. En su ausencia dichas paredes tenderían a aproximarse por efecto de la presión exterior. Por igual procedimiento variaciones en la presión atmosférica producen cambios en la forma de la caja que se transmiten al resorte y éste los indica, a través de un mecanismo de amplificación, sobre una escala graduada en unidades de presión. Los barómetros metálicos pueden mortificarse de forma que sus resultados queden registrados en un papel. De este modo se puede disponer de información sobre cómo varía la presión atmosférica con el tiempo.
Aplicación del principio de Arquímedes
Un globo de goma tiene 8 g de masa cuando está vacío. Para conseguir que se eleve se infla con gas de ciudad. Sabiendo que la densidad del aire es de 1,29 kg/m³ y la del gas de ciudad 0,53 kg/m³ determinar el volumen que, como mínimo, ha de alcanzar el globo para que comience a elevarse. Para que el globo inicie el ascenso, la fuerza del empuje ha de ser superior a la del peso:
E > P
En virtud del principio de Arquímedes:
E = V·δaire·g
Ya que en este caso el fluido desalojado es el aire. Por otra parte, el peso P será la suma del peso del globo más el peso del gas ciudad que corresponde al volumen V, es decir:
P = 8·10⁻³ kg·g + V·δgas·g
V = δaire·g > 8·10⁻³ kg·g + V·δgas·g
V·(δaire - δgas) > 8·10⁻³ kg
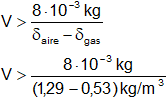
V > 10,5·10⁻³ m³
El volumen mínimo será, por tanto, de 10,5 litros.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).