Dilatación de los gases
Elevando la temperatura de una masa de gas, aumenta su volumen, si el recipiente que lo contiene se lo permite. Si el recipiente es indeformable, el volumen de la masa gaseosa no cambia, pero su presión aumenta.
Presión, volumen y temperatura son tres parámetros que definen el estado de una masa de gas. Para llegar al establecimiento de la relación que los vincula (ecuación de estado), comenzaremos por estudiar los casos simples, en que uno de los parámetros queda invariable.
El caso de t° = constante, lo estudia la ley de Boyle-Mariotte. Ahora veremos sucesivamente los casos correspondientes a variaciones de la temperatura t°, a los que llamaremos dilataciones.
Si p = constante, variará el volumen, tendremos una dilatación a presión constante.
Si V = constante, variará la presión, y el fenómeno será una dilatación a volumen constante.
Dilatación a presión constante
En este caso, al calentar el gas de 0 °C a t°, la variación del volumen es:
ΔV = Vf - V₀
Luego, llamaremos coeficiente medio de dilatación del gas a presión constante entre 0 °C y t° a la expresión:
![]()
El coeficiente α representa el aumento medio de volumen que experimenta cada unidad de volumen del gas, por cada grado de elevación de temperatura, siempre que se mantenga constante la presión.
Ley de Gay-Lussac
El coeficiente de dilatación de un gas entre 0 °C y t°, a presión constante, es independiente de la temperatura t, de la presión p y de la naturaleza del gas.
Para todos los gases, este coeficiente tendría el valor:
![]()
α = 0,003665/°C
Reducción de volúmenes
De acuerdo con la definición del coeficiente α, se tiene:
Vf = V₀ + V₀·α·t
Por tanto:
Vf = V₀·(1 + α·t)
Conocido el valor del coeficiente α, y, por tanto, el binomio 1 + α·t, se puede pasar del volumen a 0 °C al correspondiente a la temperatura t°. También se puede pasar el volumen del gas de t° a 0 °C.
Ejemplo:
t = 91 °C
Vf = 100 cm³
p = constante
![]()
![]()
Reemplazamos por los valores y calculamos:
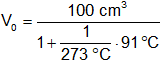
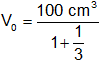
V₀ = 75 cm³
Dilatación a volumen constante
Elevando la temperatura de una masa de gas contenida en un recipiente cuyo volumen no cambia, se constata que la presión aumenta. A este fenómeno se lo llama dilatación a volumen constante.
Al variar de 0 °C a t° la temperatura, se ha producido una variación de presión:
Δp = pf - p₀
Se llama coeficiente medio de dilatación del gas a volumen constante, entre 0 °C y t°, al valor:
![]()
El coeficiente β representa al aumento medio de presión del gas, por cada unidad de presión inicial y por cada grado de elevación de temperatura, entre 0 °C y t°:
pf = p₀ + p₀·β·t
Por tanto:
pf = p₀·(1 + β·t)
Gas ideal o perfecto
Es fácil demostrar que, para un gas que cumple exactamente la ley de Boyle-Mariotte, los coeficientes de dilatación α y β son iguales.
En efecto, consideremos una masa de gas a 0 °C y presión p₀, que ocupa un volumen V₀. Calentamos esa masa de gas hasta una temperatura t, pero en un caso a presión constante y en otro caso a volumen constante, tendremos:
Vf = V₀·(1 + α·t)
pf = p₀·(1 + β·t)
Ambos estados finales corresponden a una misma temperatura t, por lo tanto, estarán vinculados por la ley de Boyle-Mariotte:
p₀·Vf = pf·V₀
Sustituyamos los valores anteriores de Vf y pf:
p₀·V₀·(1 + α·t) = p₀·V₀·(1 + β·t)
Simplificando:
1 + α·t = 1 + β·t
α·t = β·t
Finalmente:
α = β
Y si el gas cumple también la ley de Gay-Lussac, se tiene:
![]()
α = β = 0,003665/°C
Los gases reales no cumplen rigurosamente la ley de Boyle-Mariotte, tampoco cumplen en todos los casos la ley de Gay-Lussac.
Se llama gas ideal o gas perfecto a un gas que cumple rigurosamente las leyes de Boyle-Mariotte y de Gay-Lussac.
Bibliografía:
"Física elemental". José S. Fernández y Ernesto E. Galloni. Argentina.
Autor: Ricardo Santiago Netto. Argentina