Problema nº 8 de gases ideales, masa de un gas con el cambio de temperatura y presión - TP02
Enunciado del ejercicio nº 8
Un cuerpo de bomba contiene aire a 0 °C cuya presión es de 120 mm Hg; en esas condiciones el pistón, que tiene un diámetro d = 25 cm, se mantiene en equilibrio por efecto de su peso. ¿Cuánto pesa (masa) el pistón? ¿Cuánto hay que aumentar el peso para que el equilibrio se mantenga calentando el aire en 10 °C?
Desarrollo
Datos:
t = 0 °C
p = 120 mm Hg
d = 25 cm
t₂ = 10 °C
g = 9,81 m/s²
Fórmulas:
A = π·r²
![]()
P = m·g
![]()
Esquema:
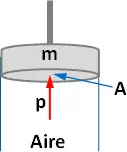
Solución
a)
La presión es:
![]()
Hallamos el área del pistón en contacto con el aire:
A = π·r²
Convertimos las unidades:
![]()
d = 0,25 m
r = d/2
r = 0,25 m/2
r = 0,125 m
Reemplazamos por los datos y calculamos:
A = π·(0,125 m)²
A = 0,049087385 m²
De la fórmula de presión despejamos el peso P:
P = p·A
Convertimos las unidades:
![]()
p = 15.998,68421 Pa
Reemplazamos por los datos y calculamos:
P = 15.998,68421 Pa·0,049087385 m²
P = 785,3335747 N
Luego hallamos la masa:
P = m·g
![]()
Reemplazamos por los valores y calculamos:
![]()
m = 80,0543909 kg
Resultado a), la masa del pistón es:
m = 80,05 kg
b)
Aplicamos la segunda ley de Charles y Gay Lussac:
![]()
Despejamos p₂:
![]()
Convertimos las unidades:
t₁ = 10 °C
T₁ = 10 °C + 273 °C
T₁ = 283 K
Reemplazamos por los datos y calculamos:
![]()
p₂ = 16.584,7166 Pa
Luego hallamos la masa como en el ítem anterior.
De la fórmula de presión despejamos el peso P:
P = p·A
P = m·g
Igualamos:
m·g = p·A
![]()
Reemplazamos por los valores y calculamos:
![]()
m₂ = 82,98678617 kg
La variación de la masa será:
Δm = m₂ - m
Reemplazamos por los datos y calculamos:
Δm = 82,98678617 kg - 80,0543909 kg
Δm = 2,932395271 kg
Resultado b), el aumento de la masa para mantener el equilibrio es:
Δm = 2,932 kg
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP02
- | Siguiente ›
Ejemplo, cómo calcular la masa de un gas con el cambio de temperatura y presión