Calor y calorimetría
El calor es la transferencia de energía de una parte a otra de un cuerpo, o entre diferentes cuerpos, en virtud de una diferencia de nivel energético. El calor es energía en tránsito; siempre fluye de una zona de mayor nivel energético a una zona de menor nivel energético, con lo que eleva la temperatura de la segunda y reduce la de la primera, siempre que el volumen de los cuerpos se mantenga constante. La energía no fluye desde un objeto de nivel energético bajo a un objeto de nivel energético alto si no se realiza trabajo.
Q = m·cₑ·ΔT
El calor, igual que el trabajo, corresponde a energía en tránsito (proceso de intercambio de energía), el calor es una transferencia de energía y puede causar los mismos cambios en un cuerpo que el trabajo. La energía mecánica puede convertirse en calor a través del rozamiento, y el trabajo mecánico necesario para producir 1 caloría se conoce como equivalente mecánico del calor. Según la ley de conservación de la energía, todo el trabajo mecánico realizado para producir calor por rozamiento aparece en forma de energía en los objetos sobre los que se realiza el trabajo. James Prescott Joule fue el primero en demostrarlo de forma fehaciente en un experimento clásico: calentó agua en un recipiente cerrado haciendo girar unas ruedas de paletas y halló que el aumento de nivel energético del agua era proporcional al trabajo realizado para mover las ruedas.
Cuando el calor se convierte en energía mecánica, como en un motor de combustión interna, la ley de conservación de la energía también es válida. Sin embargo, siempre se pierde o disipa energía en forma de calor porque ningún motor tiene una eficiencia perfecta.
Calorímetro
La calorimetría es la ciencia que mide la cantidad de energía generada en procesos de intercambio de calor. El calorímetro es el instrumento que mide dicha energía. El tipo de calorímetro de uso más extendido consiste en un envase cerrado y perfectamente aislado con agua, un dispositivo para agitar y un termómetro. Se coloca una fuente de calor en el calorímetro, se agita el agua hasta lograr el equilibrio, y el aumento de nivel energético se comprueba con el termómetro. Si se conoce la capacidad calorífica del calorímetro (que también puede medirse utilizando una fuente corriente de calor), la cantidad de energía liberada puede calcularse fácilmente. Cuando la fuente de calor es un objeto caliente de nivel energético conocida, el calor específico y el calor latente pueden ir midiéndose según se va enfriando el objeto. El calor latente, que no está relacionado con un cambio de nivel energético, es la energía térmica desprendida o absorbida por una sustancia al cambiar de un estado a otro, como en el caso de líquido a sólido o viceversa. Cuando la fuente de calor es una reacción química, como sucede al quemar un combustible, las sustancias reactivas se colocan en un envase de acero pesado llamado bomba. Esta bomba se introduce en el calorímetro y la reacción se provoca por ignición, con ayuda de una chispa eléctrica.
Ley fundamental de la calorimetría
Un sistema aislado compuesto por n cuerpos, a diferentes temperaturas, evoluciona espontaneamente hacia un estado de equilibrio en el que todos los cuerpos tienen la misma temperatura. Los calores intercambiados sumados con sus signos dan cero:
∑Qᵢ = 0
Unidades de calor
En físicas, la cantidad de calor se expresa en las mismas unidades que la energía y el trabajo, es decir, en joule (J).
La caloría es otra unidad que sirve para medir las cantidades de calor. La caloría pequeña, o caloría-gramo (cal), suele definirse en ciencia e ingeniería como la cantidad de calor necesaria para elevar la temperatura de 1 gramo de agua de 14,5 a 15,5 °C. A veces se especifica otro intervalo de temperaturas.
1 cal = 4,1840 J
En ingeniería se emplea una caloría algo diferente, la caloría internacional, que equivale a 1/860 W·h:
1 kcal = 4,1868 J
Una caloría grande o kilocaloría (Cal), muchas veces denominada también caloría, es igual a 1.000 calorías-gramo, y se emplea en dietética para indicar el valor energético de los alimentos.
Calor latente
El cambio de nivel energético de una sustancia conlleva una serie de cambios físicos. Casi todas las sustancias aumentan de volumen al ganar calorías y se contraen al ceder calor. El comportamiento del agua entre 0 y 4 °C constituye una importante excepción a esta regla.
Se denomina fase de una sustancia a su estado, que puede ser sólido, líquido o gaseoso. Los cambios de fase en sustancias puras tienen lugar a nivel energéticos y presiones definidas.
El paso de sólido a gas se denomina sublimación, de sólido a líquido fusión, y de líquido a vapor vaporización.
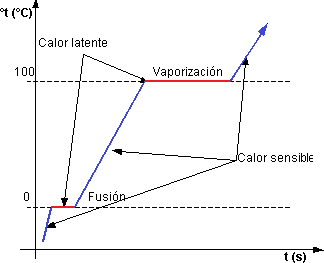
Gráfico de la temperatura en función del tiempo
Si la presión es constante (isobárico), estos procesos tienen lugar a una nivel energético constante. La cantidad de calor necesaria para producir un cambio de fase se llama calor latente; existen calores latentes de sublimación, fusión y vaporización.
Si se hierve agua en un recipiente abierto a la presión de 1 atmósfera, la temperatura no aumenta por encima de los 100 °C por mucho calor que se suministre. El calor que se absorbe sin cambiar la temperatura del agua es el calor latente; no se pierde, sino que se emplea en transformar el agua en vapor y se almacena como energía en el vapor. Cuando el vapor se condensa para formar agua, esta energía vuelve a liberarse.
Del mismo modo, si se calienta una mezcla de hielo y agua, su nivel energético no cambia hasta que se funde todo el hielo. El calor latente absorbido se emplea para vencer las fuerzas que mantienen unidas las partículas de hielo, y se almacena como energía en el agua.
Para fundir de hielo se necesitan: Clf = 19.000 J/kg
Para vaporizar agua: Cₗᵥ = 129.000 J/kg
Calor específico
El calor específico es la cantidad de calor necesaria para aumentar en un grado la temperatura de una unidad de masa de una sustancia.
En el Sistema Internacional de unidades, el calor específico se expresa en joule por kilogramo y kelvin;
[cₑ] = J/kg·K
En ocasiones también se expresa en calorías por gramo y grado centígrado.
[cₑ] = cal/g·°C
El calor específico del agua es una caloría por gramo y grado centígrado, es decir, hay que suministrar una caloría a un gramo de agua para elevar su nivel energético en un grado centígrado.
El calor específico del agua a 15 °C es:
ce-agua = 4.185,5 J/kg·°C
Si el calentamiento se produce manteniendo constante el volumen de la sustancia o su presión, se habla de calor específico a volumen constante (cᵥ) o a presión constante (cₚ). En todas las sustancias, el primero siempre es menor o igual que el segundo. En el caso del agua y de otras sustancias prácticamente incompresibles, no es necesario distinguir entre los calores específicos a volumen constante y presión constante ya que son aproximadamente iguales.
cᵥ = cₚ
De acuerdo con la ley de Dulong y Petit, para la mayoría de los elementos sólidos, el producto de su calor específico por su masa atómica es una cantidad aproximadamente constante. Si se expande un gas mientras se le suministra calor, hacen falta más calorías para aumentar su nivel energético en un grado, porque parte de la energía suministrada se consume en el trabajo de expansión. Por eso, el calor específico a presión constante es mayor que el calor específico a volumen constante.
Generalmente, los dos calores específicos de una sustancia dependen del nivel energético.
Autor: Ricardo Santiago Netto. Argentina