Termostática
Campo de la física que describe y relaciona las propiedades físicas de sistemas macroscópicos de materia y energía.
Un concepto esencial de la termodinámica es el de sistema macroscópico, que se define como un conjunto de materia que se puede aislar espacialmente y que coexiste con un entorno infinito e imperturbable. El estado de un sistema macroscópico en equilibrio puede describirse mediante propiedades medibles como la temperatura, la presión o el volumen, que se conocen como variables termodinámicas. Es posible identificar y relacionar entre sí muchas otras variables (como la densidad, el calor específico, la compresibilidad o el coeficiente de expansión térmica), con lo que se obtiene una descripción más completa de un sistema y de su relación con el entorno.
Cuando un sistema macroscópico pasa de un estado de equilibrio a otro, se dice que tiene lugar un proceso termodinámico. Las leyes o principios de la termodinámica determinan la naturaleza y los límites de todos los procesos termodinámicos.
Principio cero de la termodinámica
El término de temperatura adolece de la imprecisión del lenguaje no matemático. El llamado principio cero de la termodinámica proporciona una definición precisa, aunque empírica, de la temperatura.
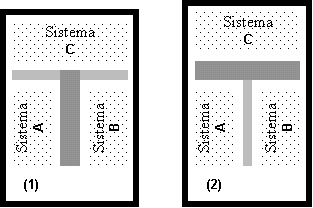
Cuando dos sistemas están en equilibrio mutuo, comparten una determinada propiedad. Esta propiedad puede medirse, y se le puede asignar un valor numérico definido. El principio cero de la termodinámica afirma que si dos sistemas distintos (a y b) están en equilibrio termodinámico con un tercero (C en 1), también tienen que estar en equilibrio entre sí (2). Esta propiedad compartida en el equilibrio es la temperatura.
Si uno de estos sistemas se pone en contacto con un entorno infinito situado a una determinada temperatura, el sistema acabará alcanzando el equilibrio termodinámico con su entorno, es decir, llegará a tener la misma temperatura que éste. El llamado entorno infinito es una abstracción matemática denominada depósito térmico; en realidad basta con que el entorno sea grande en relación con el sistema estudiado.
Temperatura
El concepto de temperatura se deriva de la idea de medir el calor o frialdad relativos y de la observación de que el suministro de calor a un cuerpo conlleva un aumento de su temperatura mientras no se produzca la fusión o ebullición. En el caso de dos cuerpos con temperaturas diferentes, el calor fluye del más caliente al más frío hasta que sus temperaturas sean idénticas y se alcance el equilibrio térmico. Por tanto, los términos de temperatura y calor, aunque relacionados entre sí, se refieren a conceptos diferentes: la temperatura es una propiedad de un cuerpo y el calor es un flujo de energía entre dos cuerpos a diferentes temperaturas.
Los cambios de temperatura tienen que medirse a partir de otros cambios en las propiedades de una sustancia. Por ejemplo, el termómetro de mercurio convencional mide la dilatación de una columna de mercurio en un capilar de vidrio, ya que el cambio de longitud de la columna está relacionado con el cambio de temperatura. Si se suministra calor a un gas ideal contenido en un recipiente de volumen constante, la presión aumenta, y el cambio de temperatura puede determinarse a partir del cambio en la presión según la ley de Gay Lussac, siempre que la temperatura se exprese en la escala absoluta.
La sensación de calor o frío al tocar una sustancia depende de su temperatura, de la capacidad de la sustancia para conducir el calor y de otros factores. Aunque, si se procede con cuidado, es posible comparar las temperaturas relativas de dos sustancias mediante el tacto, es imposible evaluar la magnitud absoluta de las temperaturas a partir de reacciones subjetivas. Cuando se aporta calor a una sustancia, no sólo se eleva su temperatura, con lo que proporciona una mayor sensación de calor, sino que se producen alteraciones en varias propiedades físicas que pueden medirse con precisión.
Al variar la temperatura, las sustancias se dilatan o se contraen, su resistencia eléctrica cambia, y en el caso de un gas su presión varía. La variación de alguna de estas propiedades suele servir como base para una escala numérica precisa de temperaturas.
Una manera más formal, y tal vez más fundamental, de expresar la ley cero es: existe una cantidad escalar, llamada temperatura, que es una propiedad de todos los sistemas termodinámicos (en estados de equilibrio), tal que la igualdad de las temperaturas es una condición necesaria y suficiente para que exista el equilibrio térmico.
Este enunciado justifica el uso de la temperatura como variable termodinámica; la formulación anterior es el corolario de este nuevo enunciado. Hablando con poco rigor, la parte esencial de la ley cero es: existe una cantidad útil llamada "temperatura".
Temperatura y energía cinética
La temperatura depende de la energía cinética media de las moléculas de una sustancia; según la teoría cinética, la energía puede corresponder a movimientos rotacionales, vibracionales y traslacionales de las partículas de una sustancia. La temperatura, sin embargo, sólo depende del movimiento de traslación de las moléculas. En teoría, las moléculas de una sustancia no presentarían actividad traslacional alguna a la temperatura denominada cero absoluto.
Medida de la temperatura y escalas
La temperatura se mide con dispositivos llamados termómetros. Un termómetro contiene una sustancia con estados fácilmente identificables y reproducibles, por ejemplo el agua pura y sus puntos de ebullición y congelación normales. Si se traza una escala graduada entre dos de estos estados, la temperatura de cualquier sistema puede determinarse poniéndolo en contacto térmico con el termómetro, siempre que el sistema sea grande en relación con el termómetro.

Según la escala Fahrenheit, a la presión atmosférica normal, el punto de solidificación del agua es de 32 °F, y su punto de ebullición es de 212 °F. La escala centígrada o Celsius, asigna un valor de 0 °C al punto de congelación del agua y de 100 °C a su punto de ebullición. En la escala Réamur, el punto fijo inferior, solidificación del agua, es 0 °R y el punto fijo superior, vapor de agua en ebullición, es 80 °R. No confundir grados Rankine (R) con grados Réamur (°R).
En ciencia, la escala más empleada es la escala absoluta o Kelvin que se simboliza con la letra K (nunca °K). En esta escala, el cero absoluto, que está situado en -273,16 °C, corresponde a 0 K, y una diferencia de un kelvin equivale a una diferencia de un grado en la escala centígrada. El punto fijo patrón usado en termometría es el punto triple del agua, al que se le atribuye el número arbitrario 273,16 K. De forma que la temperatura del punto triple del agua es 0,01 °C.
Otra escala que emplea el cero absoluto como punto más bajo es la escala Rankine (o la escala termodinámica internacional), en la que cada grado de temperatura equivale a un grado en la escala Fahrenheit. En la escala Rankine, el punto de congelación del agua equivale a 492 R, y su punto de ebullición a 672 R. Se simboliza con la letra R (nuca °R).
Conversión de grados Kelvin a centígrados:
TC = TK - 273,15 K (°C)
Conversión de grados Kelvin a Rankine:
![]()
Conversión de grados Rankine a Fahrenheit:
TF = TR - 459,67 R (°F)
Conversión de grados centígrados a Fahrenheit:
![]()
Conversión de grados centígrados a Réamur:
![]()
Conversión de grados Fahrenheit a Réamur:
![]()
Efectos de la temperatura
La temperatura desempeña un papel importante para determinar las condiciones de supervivencia de los seres vivos. Así, las aves y los mamíferos necesitan un rango muy limitado de temperatura corporal para poder sobrevivir, y tienen que estar protegidos de temperaturas extremas. Las especies acuáticas sólo pueden existir dentro de un estrecho rango de temperaturas del agua, diferente según las especies. Por ejemplo, un aumento de sólo unos grados en la temperatura de un río como resultado del calor desprendido por una central eléctrica puede provocar la contaminación del agua y matar a la mayoría de los peces originarios.
Los cambios de temperatura también afectan de forma importante a las propiedades de todos los materiales. A temperaturas árticas, por ejemplo, el acero se vuelve quebradizo y se rompe fácilmente, y los líquidos se solidifican o se hacen muy viscosos, ofreciendo una elevada resistencia por rozamiento al flujo. A temperaturas próximas al cero absoluto, muchos materiales presentan características sorprendentemente diferentes. A temperaturas elevadas, los materiales sólidos se licúan o se convierten en gases; los compuestos químicos se separan en sus componentes.
La temperatura de la atmósfera se ve muy influida tanto por las zonas de tierra como de mar. En enero, por ejemplo, las grandes masas de tierra del hemisferio norte están mucho más frías que los océanos de la misma latitud, y en julio la situación es la contraria. A bajas alturas, la temperatura del aire está determinada en gran medida por la temperatura de la superficie terrestre. Los cambios periódicos de temperatura se deben básicamente al calentamiento por la radiación del Sol de las zonas terrestres del planeta, que a su vez calientan el aire situado por encima. Como resultado de este fenómeno, la temperatura disminuye con la altura, desde un nivel de referencia de 15 °C en el nivel del mar (en latitudes templadas) hasta unos -55 °C a 11.000 m aproximadamente. Por encima de esta altura, la temperatura permanece casi constante hasta unos 34.000 m.
Autor: Ricardo Santiago Netto. Argentina
¿Qué es la dilatación de un sólido? ¿Cómo es la dilatación de los líquidos? ¿Qué es la dilatación térmica?