Electroquímica, electrólisis y pilas (primera parte)
Electroquímica: es la parte de la química que trata de la relación entre las corrientes eléctricas y las reacciones químicas, y de la conversión de la energía química en eléctrica y viceversa. En un sentido más amplio, la electroquímica es el estudio de las reacciones químicas que producen efectos eléctricos y de los fenómenos químicos causados por la acción de las corrientes o voltajes.
Introducción
Todas las reacciones químicas son fundamentalmente de naturaleza eléctrica, puesto que hay electrones involucrados en todos los tipos de enlaces químicos. Sin embargo, la electroquímica es primordialmente el estudio del fenómeno de óxido-reducción.
Las relaciones entre cambios químicos y energía eléctrica tienen importancia teórica y práctica. Las relaciones químicas pueden utilizarse para producir energía eléctrica (en pilas que se llaman pilas voltaicas o galvánicas). La energía eléctrica puede utilizarse para realizar transformaciones químicas (en pilas electrolíticas). Además el estudio de los procesos electroquímicos lleva a la comprensión y a la sistematización de los fenómenos de óxido-reducción que ocurren fuera de las pilas.
Corriente eléctrica y movimiento de iones
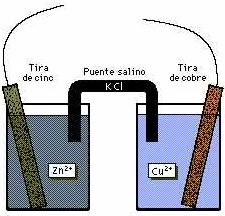
Esquema de una pila voltaica
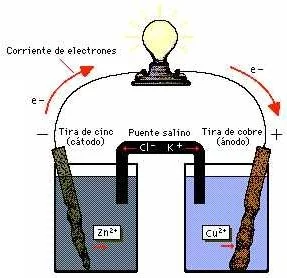
Circulación de electrones en una pila voltaica
Célula voltaica
Una célula voltaica aprovecha la electricidad de una reacción química espontánea para encender una bombilla (foco). Las tiras de cinc y cobre, dentro de disoluciones de ácido sulfúrico diluido y sulfato de cobre respectivamente, actúan como electrodos. El puente salino (en este caso cloruro de potasio) permite a los electrones fluir entre las cubetas sin que se mezclen las disoluciones. Cuando el circuito entre los dos sistemas se completa (como se muestra a la derecha), la reacción genera una corriente eléctrica. Obsérvese que el metal de la tira de cinc se consume (oxidación) y la tira desaparece. La tira de cobre crece al reaccionar los electrones con la disolución de sulfato de cobre para producir metal adicional (reducción). Si se sustituye la bombilla por una batería la reacción se invertirá, creando una célula electrolítica.
La mayoría de los compuestos inorgánicos y algunos de los orgánicos se ionizan al fundirse o cuando se disuelven en agua u otros líquidos; es decir, sus moléculas se disocian en componentes cargados positiva y negativamente que tienen la propiedad de conducir la corriente eléctrica. Si se coloca un par de electrodos en una disolución de un electrólito (o compuesto ionizable) y se conecta una fuente de corriente contínua entre ellos, los iones positivos de la disolución se mueven hacia el electrodo negativo y los iones negativos hacia el positivo. Al llegar a los electrodos, los iones pueden ganar o perder electrones y transformarse en átomos neutros o moléculas; la naturaleza de las reacciones del electrodo depende de la diferencia de potencial o voltaje aplicado.
La acción de una corriente sobre un electrólito puede entenderse con un ejemplo sencillo. Si el sulfato de cobre se disuelve en agua, se disocia en iones cobre positivos e iones sulfato negativos. Al aplicar una diferencia de potencial a los electrodos, los iones cobre se mueven hacia el electrodo negativo, se descargan, y se depositan en el electrodo como elemento cobre. Los iones sulfato, al descargarse en el electrodo positivo, son inestables y combinan con el agua de la disolución formando ácido sulfúrico y oxígeno. Esta descomposición producida por una corriente eléctrica se llama electrólisis.
En todos los casos, la cantidad de material que se deposita en cada electrodo al pasar la corriente por un electrólito sigue la ley descubierta por el químico físico británico Michael Faraday. Esta ley afirma que la cantidad de material depositada en cada electrodo es proporcional a la intensidad de la corriente que atraviesa el electrólito, y que la masa de los elementos transformados es proporcional a las masas equivalentes de los elementos, es decir, a sus masas atómicas divididas por sus valencias.
Todos los cambios químicos implican una reagrupación o reajuste de los electrones en las sustancias que reaccionan; por eso puede decirse que dichos cambios son de carácter eléctrico. Para producir una corriente eléctrica a partir de una reacción química, es necesario tener un oxidante, es decir, una sustancia que gane electrones fácilmente, y un reductor, es decir, una sustancia que pierda electrones fácilmente. Las reacciones de este tipo pueden entenderse con un ejemplo, el funcionamiento de un tipo sencillo de pila (batería) electroquímica. Al colocar una varilla de cinc en una disolución diluida de ácido sulfúrico, el cinc, que es un reductor, se oxida fácilmente, pierde electrones y los iones cinc positivos se liberan en la disolución, mientras que los electrones libres se quedan en la varilla de cinc. Si se conecta la varilla por medio de un conductor a un electrodo de metal inerte colocado en la disolución de ácido sulfúrico, los electrones que están en este circuito fluirán hacia la disolución, donde serán atrapados por los iones hidrógeno positivos del ácido diluido. La combinación de iones y electrones produce gas hidrógeno, que aparece como burbujas en la superficie del electrodo. La reacción de la varilla de cinc y el ácido sulfúrico produce así una corriente en el circuito externo. Una pila electroquímica de este tipo se conoce como pila primaria o pila voltaica.
En la batería de acumuladores, o acumulador (conocida comúnmente como pila secundaria), se proporciona energía eléctrica desde una fuente exterior, que se almacena en forma de energía química. La reacción química de una pila secundaria es reversible, es decir, se produce en un sentido cuando se carga la pila, y en sentido opuesto cuando se descarga. Por ello, una pila secundaria puede descargarse una y otra vez.
Aplicaciones industriales
La descomposición electrolítica es la base de un gran número de procesos de extracción y fabricación muy importantes en la industria moderna. La sosa cáustica (un producto químico importante para la fabricación de papel, rayón y película fotográfica) se produce por la electrólisis de una disolución de sal común en agua. La reacción produce cloro y sodio. El sodio reacciona a su vez con el agua de la pila electrolítica produciendo sosa cáustica. El cloro obtenido se utiliza en la fabricación de pasta de madera y papel.
Una aplicación industrial importante de la electrólisis es el horno eléctrico, que se utiliza para fabricar aluminio, magnesio y sodio. En este horno, se calienta una carga de sales metálicas hasta que se funde y se ioniza. A continuación, se deposita el metal electrolíticamente.
Los métodos electrolíticos se utilizan también para refinar el plomo, el estaño, el cobre, el oro y la plata. La ventaja de extraer o refinar metales por procesos electrolíticos es que el metal depositado es de gran pureza. La galvanotécnia, otra aplicación industrial electrolítica, se usa para depositar películas de metales preciosos en metales base. También se utiliza para depositar metales y aleaciones en piezas metálicas que precisen un recubrimiento resistente y duradero. La electroquímica ha avanzado recientemente desarrollando nuevas técnicas para colocar capas de material sobre los electrodos, aumentando así su eficacia y resistencia. Tras el descubrimiento de ciertos polímeros que conducen la electricidad, es posible fabricar electrodos de polímeros.
Conducción metálica
Una corriente eléctrica es el flujo de la carga eléctrica. En los metales esta carga es llevada por los electrones y la conducción eléctrica de este tipo se llama conducción metálica. La corriente resulta de la aplicación de una fuerza eléctrica suministrada por una pila, batería, o alguna otra fuente de energía eléctrica. Se necesita un circuito completo para producir una corriente.
Los cristales metálicos pueden describirse en los términos de nubes de electrones en movimiento atravesando las redes relativamente fijas de los iones metálicos positivos. Cuando los electrones se dirigen hacia una terminal del alambre metálico, los electrones en movimiento desplazan otros electrones de la nube en el punto de entrada. Los electrones desplazados, a su vez, adquieren nuevas posiciones empujando los electrones vecinos hacia delante y este efecto se trasmite por el alambre hasta que los electrones son forzados fuera del alambre en el extremo opuesto. La fuente de energía puede ser considerada un bomba de electrones, pues sirve para forzar a los electrones por uno de los terminales de circuito y sacarlos por el otro extremo. En cualquier posición en el alambre, se conserva la neutralidad eléctrica, pues la velocidad de entrada de los electrones iguala la velocidad de salida de los mismos. Hace mucho se conoce la analogía entre el flujo de la electricidad fue descrita en términos de una corriente de " fluido eléctrico". Convencionalmente, desde hace tiempo (en los tiempos de Benjamin Franklin, 1.747), antes de que se identificara el electrón, se adscribe una carga positiva a esta corriente. Interpretaremos los circuitos eléctricos en términos del movimiento del electrón. Sin embargo, debemos recordar que la corriente eléctrica convencional es descrita arbitrariamente como positiva y fluye en dirección opuesta.
La corriente eléctrica se mide en ampere (A). La cantidad de carga eléctrica se mide en coulomb (C); el coulomb se define como la cantidad de electricidad transmitida en un segundo mediante una corriente de un ampere. Por consiguiente:
1 A = 1 C/s y 1 C = 1 A·s
La corriente eléctrica se hace pasar a través del circuito mediante una diferencia de potencial eléctrico, el cual se mide en volt (V). Se necesita un joule de trabajo para mover un coulomb desde un potencial más bajo a uno más alto cuando la diferencia de potencial es de un volt. Un volt, por consiguiente, es igual a un joule/coulomb y un volt·coulomb es una unidad de energía e igual a un joule.
1 V = 1 J/C
1 V·C = 1 J
Mientras mayor sea la diferencia de potencial entre dos puntos en un alambre dado, mayor será la corriente que transporte el alambre entre estos dos puntos. Georg Simon Ohm, en 1.826, expreso la relación cuantitativa entre la diferencia de potencial, E, en volt y la corriente, I, en ampere, como:
I = E/R ó E = I·R
Donde la constante de proporcionalidad, R, de la ley de Ohm se llama la resistencia. La resistencia se mide en ohm (Ω). Se requiere un volt para transportar una corriente de un ampere a través de una resistencia de un ohm.
La resistencia para el flujo de electricidad en los metales es originada probablemente por la vibración de los iones metálicos en sus posiciones del cristal. Estas vibraciones interfieren con el movimiento de los electrones y retardan la corriente. A medida que aumenta la temperatura, aumenta el movimiento térmico de los iones metálicos. Por lo tanto, la resistencia de los metales aumenta y se convierten en conductores deficientes.
Conducción electrolítica
La conducción electrolítica, en la cual la carga es transportada por los iones, no ocurrirá a menos que los iones del electrólito se puedan mover libremente. Por consiguiente, la conducción electrolítica es exhibida principalmente por sales fundidas y por soluciones acuosas de electrólitos. Por consiguiente, una corriente que pase a través de un conductor electrolítico requiere que el cambio químico acompañe el movimiento de los iones.
Estos principios de conducción electrolítica se ilustran mejor refiriéndonos a una pila electrolítica tal como la representa la figura "1", para la electrólisis del NaCl fundido entre electrodos inertes (los electrodos inertes no participan en reacciones de electrodos). La fuente de corriente envía electrones hacia el electrodo izquierdo, el cual, por lo tanto, puede considerarse cargado negativamente. Los electrones salen del electrodo de la derecha, el electrodo positivo. En el campo eléctrico así producido, los iones de sodio (catiónes) son atraídos hacia el polo positivo (ánodo). La carga eléctrica en la conducción electrolítica es transportada por los cationes que se mueven hacia el cátodo y los aniones que se mueven en dirección opuesta hacia el ánodo.
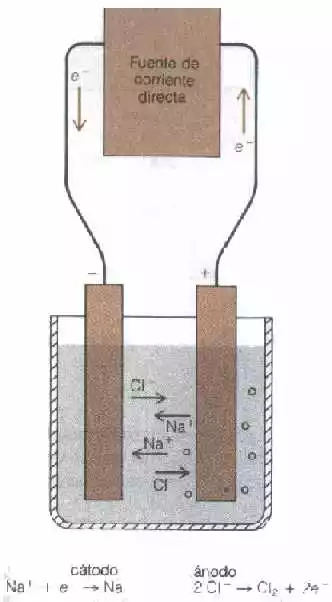
Figura "1" Electrólisis del cloruro de sodio fundido
Para un circuito completo la reacción del electrodo debe acompañar el movimiento de los iones. En el cátodo algunas especies químicas (no necesariamente el transportador de carga) debe aceptar electrones y debe reducirse. En el ánodo, los electrones deben ser separados de algunas especies químicas que, como consecuencia, se oxidan. Las convenciones relativas a los términos ánodo y cátodo se resumen el la tabla A.
| Cátodo | Anodo | |
|---|---|---|
| Iones atraídos Dirección del movimiento electrónico Media reacción | Cationes Dentro de la pila Reacción | Aniones Fuera de la pila oxidación |
| Signo | ||
| Pila de electrólisis Pila galvánica | Negativo Positivo | Positivo Negativo |
En la pila del diagrama, los iones sodio se reducen en el cátodo:
Na⁺ + e⁻ ⟶ Na.
Y los iones cloruro se oxidan en el ánodo:
2·Cl⁻ ⟶ Cl₂ + 2·e⁻
La suma adecuada de estas dos ecuaciones parciales de la reacción para toda la pila es:
2·NaCl(l) ⟶ electrólisis ⟶ 2·Na(l) + Cl₂(g)
En la operación real de una pila comercial utilizada para producir sodio metálico, se agrega cloruro de calcio para hacer descender el punto de fusión del cloruro de sodio y la pila se opera a una temperatura aproximada de 600 °C. A esta temperatura, el sodio metálico es un líquido.
Podemos trazar el flujo de la carga negativa a través del circuito de la figura "1" como sigue: los electrones dejan la fuente de corriente y son enviados al cátodo donde son recogidos y reducidos los iones sodio que han sido atraídos a este electrodo negativo. Los iones cloruro se mueven del cátodo hacia el ánodo y así transportan carga negativa en esta dirección. En el ánodo, los electrones son removidos de los iones cloruro, oxidándolos a cloro gaseoso. Estos electrones son sacados de la pila por la fuente de corriente. En esta forma, se completa el circuito.
La conducción electrolítica se basa entonces sobre la movilidad de los iones y cualquier cosa que inhiba el movimiento de estos origina una resistencia a la corriente.
Los factores que influyen en la conductividad eléctrica de las soluciones de electrolitos incluyen atracciones interiónicas, solvatación de iones y viscosidad del disolvente. Estos factores se fundamentan sobre atracciones soluto-soluto y soluto-disolvente e interacciones disolvente-disolvente, respectivamente. El promedio de energía cinética de los iones soluto aumenta a medida que se eleva la temperatura y, por consiguiente, la resistencia de los conductores electroliticos disminuye por lo general a medida que se aumenta la temperatura.
En todo momento, la solución es eléctricamente neutra. La carga total positiva de todos los cationes iguala la carga total negativa de todos los aniones.
Electrolisis
La electrólisis del cloruro de sodio fundido sirve como fuente comercial de sodio metálico y cloro gaseoso. Procedimientos similares se usan para preparar otros metales muy activos (tales como potasio y calcio). Cuando se electrolizan ciertas soluciones acuosas, el agua esta involucrada en las reacciones de los electrodos en vez de los iones derivados del soluto; por lo tanto, los iones transportadores de corriente no se descargan necesariamente en los electrodos.
En la electrólisis del sulfato de sodio acuoso, los iones sodio se desplazan hacia el cátodo y los iones sulfato se mueve hacia el ánodo (figura "2"). Ambos iones se descargan difícilmente; cuando esta electrólisis se lleva a cabo entre los electrodos inertes, se desprende hidrógeno gaseoso en el cátodo y la solución que rodea el electrodo se hace alcalina.
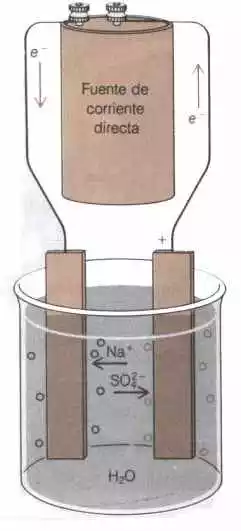 | |
| Cátodo | Ánodo |
| Figura "2" Electrólisis del sulfato de sodio acuoso | |
2·e⁻ + 2·H₂O ⟶ H₂(g) + 2·OH⁻ ⟶ 2·H₂O ⟶ O₂(g) + 4·H⁺ + 4·e⁻
La reducción ocurre en el cátodo pero en vez de la reducción del ion sodio.
e⁺ + Na⁺ ⟶ Na.
El cambio neto que ocurre es la reducción del agua.
2·e⁻ + 2·H₂O ⟶ H₂(g) + 2·OH⁻
El agua es un electrolito demasiado débil. El agua pura se ioniza aproximadamente 2·10⁻⁷ % a 25 °C.
2·H₂O ⇄ H₃O⁺ + OH⁻
O, más brevemente,
H₂O ⇄ H⁺ + OH⁻
No se conoce el mecanismo exacto de la reacción en el cátodo de la electrólisis del Na₂SO₄ acuoso. Puede ser que los iones de hidrógeno del agua se descargan y que la reacción procede como sigue:
H₂O ⇄ H⁺ + OH⁻
2·e⁻ + 2·H⁺ ⟶ H₂(g)
La multiplicación de la primera ecuación por 2 seguida por la adición de las dos ecuaciones da el cambio sigue:
2·e⁻ + 2·H₂O ⟶ H₂(g) + 2·OH⁻
En general, el agua se reduce en el cátodo (produciendo hidrógeno gaseoso e iones hidróxido) a pesar de que el catión del soluto es difícil de reducir.
La oxidación ocurre en el ánodo y en la electrólisis del Na₂SO₄ acuoso, los aniones (SO₄⁼) que emigran hacia el ánodo son difíciles de oxidar:
2·SO₄⁼ ⟶ S₂O₈⁼ + 2·e⁻
Por consiguiente, la oxidación del agua se efectúa preferencialmente. La forma de esta reacción puede ser:
H₂O ⇄ H⁺ + OH⁻
4·OH⁻ ⇄ O₂(g) + 2·H₂O + 4·e⁻
Multiplicando la primera ecuación por 4 y sumando la ecuaciones, obtenemos el cambio neto:
2·H₂O ⟶ O₂(g) + 4·H⁺ + 4·e⁻
En el ánodo se observa el desplazamiento del oxígeno gaseoso y la solución que rodea al polo se vuelve ácida. En general, el agua se oxida en el ánodo (produciendo oxígeno gaseoso e iones de hidrógeno) mientras que el anión del soluto es difícil de oxidar.
La reacción completa para la electrólisis del Na₂SO₄ acuoso se puede obtener sumando las reacciones del ánodo y del cátodo:
| 2·[2·e⁻ + 2·H₂O | ⟶ | H₂(g) + 2·OH⁻] |
| 2·H₂O | ⟶ | O₂(g) + 4·H⁺ + 4·e⁻ |
| 6·H₂O | ⟶ | 2·H₂(g) + O₂(g) + 4·H⁺ + 4·OH⁻ |
Si se mezcla la solución, los iones hidrógeno e hidróxido producidos se neutralizan entre si y el cambio neta.
2·H₂O electrólisis ⟶ 2·H₂(g) + O₂(g)
Es meramente la electrólisis del agua. En el transcurso de la electrólisis, el ion hidrógeno se aleja del ánodo, de donde se produce, hacia el cátodo. En forma similar, los iones hidróxido se mueven hacia el ánodo. Estos iones se neutralizan entre si en la solución entre los dos electrodos.

Se utilizan evaporadores para obtener hidróxido de sodio de la solución derivada de la electrólisis de cloruro de sodio acuoso
La electrólisis de una solución acuosa de NaCl entre electrodos inertes sirve como un ejemplo de un proceso en el cual se descarga el anión del electrolito, pero el catión no:
| Anodo | 2·Cl⁻ | ⟶ | Cl₂(g) + 2·e⁻ |
| Cátodo | 2·e⁻ + 2·H₂O | ⟶ | H₂(g) + 2·OH⁻ |
| 2·H₂O + 2·Cl⁻ | ⟶ | H₂(g) + Cl₂(g) + 2·OH⁻ |
Puesto que el ion sodio permanece sin modificación en la solución, la reacción se puede indicar.
2·H₂O + 2·Na⁺ + 2·Cl⁻ electrólisis ⟶ H₂(g) + Cl₂(g) + 2·Na⁺ + 2·OH⁻
Este proceso es una fuente comercial del hidrógeno gaseoso, cloro gaseoso y, por evaporación de la solución restante de la electrólisis, hidróxido de sodio.
En la electrólisis de una solución de CuSO₄ entre electrodos, la corriente es transportada por los iones Cu²⁺ y SO₄⁼. La corriente que transporta los cationes se descarga, pero los aniones no:
| Anodo | 2·H₂O ⟶ O₂(g) + 4·H⁺ + 4·e⁻ |
| Cátodo | 2·[2·e⁻ + Cu²⁺ ⟶ Cu(s)] |
| 2·Cu⁺ + 2·H₂O ⟶ O₂(g) + 2·Cu(s) + 4·H⁺ |
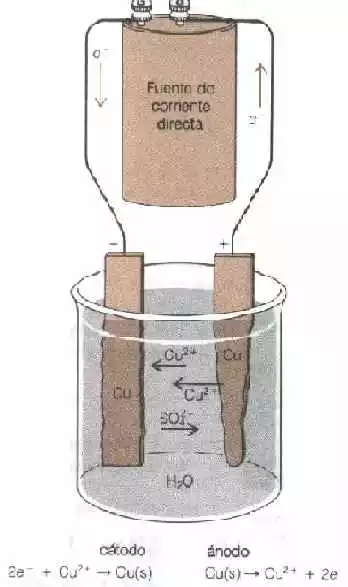
Figura "3" Electrólisis de una solución de sulfato cúprico entre electrodos de cobre
Por supuesto, es posible tener ambos iones del sulfato descargados durante la electrólisis de una solución acuosa. Un ejemplo es la electrólisis del CuCl₂ entre electrodos inertes:
| Anodo | 2·Cl⁻ | ⟶ | Cl₂(g) + 2·e⁻ |
| Cátodo | 2·e⁻ + Cu²⁺ | ⟶ | Cu(s) |
| Cu²⁺ + 2·Cl⁻ | ⟶ | Cu(s) + Cl₂(g) |
También es posible tener el electrodo mismo dentro de una reacción de electrodo. Si el CuSO₄ se electroliza entre dos electrodos de cobre (figura 3), los iones Cu²⁺ se reducen en el cátodo.
2·e⁻ + Cu²⁺ ⟶ Cu
Pero de las tres posibles oxidaciones anódicas:
2·SO₄⁼ ⟶ 2·S₂O₄⁼ + 2·e⁻
2·H₂O ⟶ O₂(g) + 4·H⁺ + 4·e⁻
Cu(s) ⟶ Cu²⁺ + 2·e⁻
Se observa que ocurre la oxidación del cobre metálico del electrodo. Por esto, en el ánodo, el cobre del electrodo va a la solución como iones Cu²⁺ y, en el cátodo, los iones Cu²⁺ se depositan como Cu(s) sobre el electrodo. Este proceso se usa para refinar cobre. El cobre contaminado se utiliza como el ánodo de una pila electrolítica y la solución de CuSO₄ está electrolizada. El cobre puro se deposita sobre el cátodo. Los electrodos activos también son utilizados en los procesos de electroplateado. En el electroplateado de plata, se utilizan ánodos de plata.
Estequiometria de la electrólisis
Las relaciones cuánticas entre electricidad y cambio químico fueron descritas originalmente por Michael Faraday en 1.832 y 1.833. El trabajo de Faraday se conoce mejor por la referencia a las medias reacciones que ocurren durante la electrólisis. El cambio en el cátodo durante la electrólisis del cloruro de sodio fundido:
Na⁺ + e⁻ ⟶ Na.
Indica que requiere un electrón para producir un átomo de sodio. Se requiere un mol electrones (número de Avogadro de electrones) para producir un mol de átomos de sodio metálico (22,9898 g de Na). La cantidad de carga equivalente a un mol electrones se llama faradio (F) y se encontró que es igual a 96,485 coulomb (C), el cual, para problemas de trabajo, por lo general se ha aproximado a 96,5 C.
1 F = 96,5 C
Si se utilizan 2 F de electricidad, se producirán dos moles de Na al mismo tiempo que el equivalente de electrones a 1 F de electricidad se agrega al cátodo, ese mismo número de electrones se saca del ánodo,
2·Cl⁻ ⟶ Cl₂(g) + 2·e⁻
La extracción de 1 mol de electrones (1 F) del ánodo dará como resultado la descarga de 1 mol de iones Cl⁻ y la producción de 0,5 moles de cloro gaseoso.
Si 2 F de electricidad fluyen a través de la pila, 2 moles de iones Cl⁻ se descargaran y 1 mol de Cl₂ gas se libera.
Por consiguiente, las reacciones de los electrodos pueden interpretarse en términos de moles y faradays. La oxidación del ion hidróxido en el ánodo, por ejemplo,
4·OH⁻ ⟶ O₂(g) + 2·H₂O + 4·e⁻
Puede leerse como que dice que 4 moles de iones OH⁻ producen 1 mol de O₂ gaseoso y 2 moles de H₂O cuando pasan 4 F de electricidad a través de la pila.
Las relaciones entre moles de sustancias y faradays de electricidad son las bases de los cálculos estequeométricos que comprende la electrólisis. Recordemos que un ampere (1 A) es igual a la velocidad de una corriente de un coulomb (1 C) por segundo.
1 A = 1 C/s
En la figura 4 dos pilas electrolíticas se montan es serie. La electricidad pasa primero a través de una pila y luego a través de la otra antes de regresar a la fuente de corriente. Si se electroliza nitrato de plata en una de las pilas, la reacción catódica es:
Ag⁺ + e⁻ ⟶ Ag(s)
Y se deposita plata metálica en el electrodo utilizado. Si se pesa este electrodo antes y después de la electrólisis, si se puede determinar la cantidad de plata depositada y, por lo tanto, el número de coulomb que pasan a través de la pila. Un faraday depositara 107,868 g de plata. Por consiguiente, un coulomb es equivalente a,
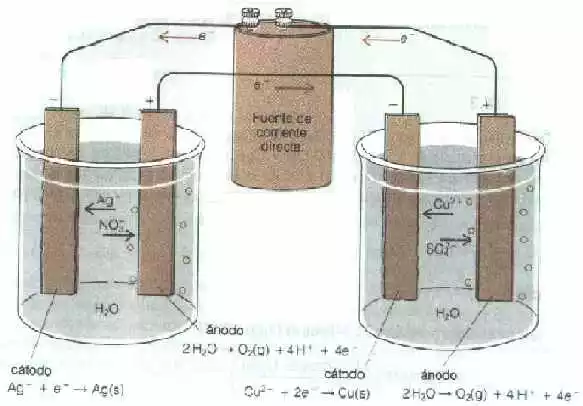
Figura "4" coulómetro de plata en serie con una pila electrólisis
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).
- ‹ Anterior
- |
- Siguiente ›