Inhibición
El efecto de un inhibidor es disminuir o bloquear la velocidad de una reacción catalizada uniéndose al enzima. La mayor parte de los enzimas están afectados. Son específicos, cualquier sustancia no sirve para unir cualquier enzima. Se alteran grupos importantes para la función catalítica o se altera ligeramente la conformación (con lo que la proteína ya no es activa) sin llegar a desnaturalizarlo. Los inhibidores sirven para distinguir los grupos esenciales.
Inhibición permanente: unión del inhibidor irreversible por medio de enlaces covalentes provocando una modificación química de los grupos catalíticos. Una vez modificado la enzima está siempre inhibido. Para distinguirlo de los reversible se someten a diálisis y si no se separan enzima e inhibidor es permanente. Ejemplo: el iodoacetato reconoce grupos SH y OH y envenena la cisteína.
![]()
Inhibición reversible: La unión del inhibidor y la enzima es reversible. Al quitar el inhibidor del medio se recupera la actividad. Hay varios tipos:
- Competitiva: inhibidor y sustrato compiten por unirse al enzima en el mismo sitio de manera que no se unen a la vez.
KI = [E]·[I]/[EI]
Para eliminar el inhibidor (y aumentar la velocidad) aumentamos la concentración de sustrato y lo desplazamos. La V no se verá afectada porque V = KCAT [ET] aunque necesitaremos concentración de sustrato más alta que en ausencia de inhibidor. Cinéticamente se puede distinguir el tipo de inhibidor. Kₘ determina la afinidad de la enzima por el sustrato (concentración de enzima y velocidad constantes). Un inhibidor competitivo es como si bajara la afinidad y Kₘ será mayor. La Kₘ con inhibidor será Kₘ² x () donde () depende de:
- Concentración de inhibidor: influye positivamente (+inhibidor, +Kₘ)
- KI: gobierna la unión de inhibidor y enzima. Como está escrita en el sentido de la disociación cuanto más aumente KI menor será Kₘ.
Kₘ² = Kₘ·() + [I]/KI
Haciendo la gráfica de doble inverso se averigua si el inhibidor es competitivo:
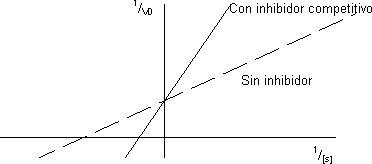
La recta tendrá la misma V pero la pendiente será más grande porque Kₘ es mayor, cortará en el mismo punto de ordenadas. Al aumentar la concentración de inhibidor la Kₘ sube y se origina una familia de rectas que cortan a las ordenadas en el mismo punto y tienen la pendiente más grande.
Un inhibidor competitivo ha de cumplir un requisito: ser parecido al sustrato estructuralmente porque se acopla al mismo sitio activo. El succinato deshidrogenasa cataliza la reacción redox del succinato:
| Succinato deshidrogenasa | ||
| Succinato | Fumarato |
Dos inhibidores competitivos del succinato deshidrogenasa:
- Oxalacetato: COO⁻—CO—CH₃—COO⁻
- Malonato: COO⁻—CH₂—COO⁻
- Inhibición acompetitiva: el inhibidor sólo se une al complejo enzima - sustrato, que ya no formará producto, por lo que la velocidad bajará. El inhibidor no se une al centro activo sino a cualquier otro sitio, lo que hace que cambie la conformación y la enzima ya no es tan efectivo.
K'I = [E]·[I]/[ESI]
No se puede superar la inhibición aumentando la concentración de sustrato. La V con inhibidor (VI) será más pequeña.
| VI = | V | |
| 1 + | [I] | |
| K'I | ||
La Kₘ será más pequeña, como si tuviera más afinidad:
| KₘI = | Kₘ | |
| 1 + | [I] | |
| K'I | ||
El resultado es una recta nueva que corta en un valor más grande de ordenadas y con pendiente igual. Si aumentamos la concentración de inhibidor obtenemos una familia de rectas con pendiente igual y corte en ordenadas más grande.
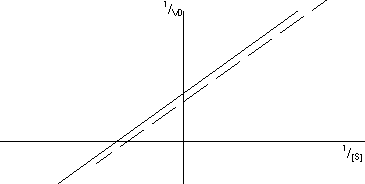
- Inhibición mixta: intermedia entre acompetitiva y competitiva. El inhibidor (que no tiene porqué parecerse al sustrato) no se une al centro activo aunque tiene efecto de competitivo. La unión de uno y otro no son excluyentes. El resultado final depende de cual de los dos prevalezca.
Competitiva:
| V | Kₘ sube | Kₘ = 1 + [I]/KI | ||
| 1 + [I]/KI |
Acompetitiva:
| V no afectada | Kₘ baja | Kₘ = 1 + [I]/KI |
Competitiva + Acompetitiva:
| Kₘ = | 1 + [I]/KI |
| 1 + [I]/K'I |
El valor del punto de corte en ordenadas depende del efecto que prevalezca.
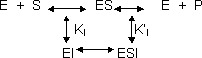
- Inhibición no competitiva: si KI = K'I el inhibidor se une por igual al enzima que al complejo enzima - sustrato y KₘI = Kₘ. El punto de corte en abscisas es igual con inhibidor que sin él. En ordenadas es más grande por lo que V baja. Si Kₘ se mantiene igual y V baja la pendiente aumenta.
| E + S ⇔ | Es ⇔ | E + P |
| ↓KI | ↓ KII | |
| EI ⇔ | ESI |
| VI < V ⇌ VI = | V | |
| 1 + | [I] | |
| K'I | ||
| KIₘ Kₘ ⇌ KₘI = | 1 + [I]/KI |
| 1 + [I]/K'I |
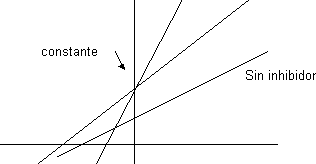
El punto de corte con las abscisas da prueba de la importancia de relativa del efecto competitivo o acompetitivo para que lo corte por encima o por debajo.
- Inhibición no competitiva: cuando KI = K'I. En este caso da igual unirse al enzima que al complejo enzima - sustrato, aunque no se transformará igual de bien porque V es diferente. Cuanto más se parezca el inhibidor al estado de transición del sustrato más eficaz será el inhibidor. Son inhibidores muy potentes de la actividad catalítica de la enzima.
Efecto del pH y de la temperatura sobre la actividad enzimática
- Efecto del pH: afecta al estado de disociación de los grupos, aunque todas las proteínas no se ven afectadas de igual forma porque algunas no tienen grupos disociables. La mayor parte de los enzimas tienen un pH óptimo. Si hay pequeños cambios de pH no se desnaturaliza la enzima. El pH puede afectar de dos maneras:
- La unión del sustrato es mejor o peor que antes
- Que afecte a la velocidad catalítica de la reacción
La velocidad enzimática se mide en M/ₜ y la actividad enzimática en mol/ₜ, y la unidad internacional µmol/min, cantidad de enzima que transforma un micromol de sustrato en producto en un minuto en condiciones óptimas. Otra unidad es la cantidad enzimática que se requiere para transformar 1 mol/ₛ y se la llama katal.
- Efecto de la temperatura: cuando la temperatura sube la velocidad de reacción aumenta. Existe una temperatura máxima a la cual la proteína se desnaturaliza dejando de ser funcional. La mayor parte de los enzimas se desnaturalizan a unos 50 °C. La ribonucleasa se desnaturaliza a temperaturas superiores a los 70 °C.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).