Mecanismos moleculares de la regulación enzimática
Regulación de la actividad enzimática
Controlando la actividad de la enzima se controla su velocidad y así se puede obtener el producto final antes o después según convenga. La célula sigue el principio de máxima economía dentro del mayor orden posible, minimizando la cantidad de intermediarios sin utilidad. También se integran la reacciones de manera que no obtendrá energía si no la va a utilizar. Tampoco se regula la actividad de los enzimas porque con regular sólo uno de la ruta de reacciones se controla el resto, En una ruta hay reacciones que están continuamente en equilibrio y otras que no, el punto de control estará siempre estará en las últimas porque la enzima más lento será el paso limitante de la velocidad. Es preferible que el paso limitante esté al principio de la ruta porque así no se acumulan los intermediarios.
Regulación de la velocidad
Una reacción enzimática depende de la concentración de enzima presente, modificándola se varía la velocidad de dos maneras:
- Síntesis de la molécula
- Degradación de la molécula
Normalmente son respuestas a largo plazo, se puede dar cuando ------ la fuente de alimentación en las células. Otra posibilidad más rápida es controlar la actividad de la enzima ya sintetizado. Esta actividad dependerá de la concentración de enzima, Kₘ y KCAT
Codificación de la concentración de enzima
La regulación de la síntesis de enzimas se puede hacer a nivel transcripcional o traduccional. Este tipo de regulación existe en eucariotas y en procariotas. En eucariotas es a dos niveles. En procariotas es a nivel transcripcional. La bacteria E. Coli varía los enzimas dependiendo del medio en el que se encuentre. Los enzimas que no varían nunca su concentración en la célula de denominan constitutivos y a los otros inducibles.
Operón LAC
Propuesto por François Jacob y Jacques-Lucien Monod. La bacteria puede utilizar como fuente de carbono la glucosa, pero si no hay usará lactosa para obtenerla. En el DNA habrá un sitio donde está codificado la enzima que romperá la lactosa en glucosa y galactosa. Cuando no hay lactosa este sitio no se puede leer porque estará bloqueado por delante por una proteína. Si hay lactosa ésta se unirá a esa proteína que ya no podrá bloquear al no poder unirse, consiguiéndose la enzima encargada de la ruptura de la lactosa, la β-galactosidasa. Un operón es un mensajero con información de varios genes. Es frecuente en procariotas y raro en eucariotas.
Otra manera de modificarlo es actuando sobre la degradación, a cargo de enzimas proteolíticos llamados proteasas. Al disminuir la degradación aumenta la concentración de enzima. Se puede incidir sobre el mismo enzima o sobre el que lo degrada. Existen señales para marcar a los enzimas que van a ser degradados o no por las proteasas.
La velocidad de reacción también se puede regular de otra forma más rápida modificando la actividad de la enzima presente. La actividad de la enzima dependerá de la concentración de sustrato presente, Kₘ y KCAT la regulación e la actividad sirve para bloquear o poner en marcha una ruta metabólica en pocos segundos. El caso más sencillo es cuando la enzima es autorregulable:
- Si la concentración de sustrato aumenta la actividad de la enzima aumenta
- Si la concentración de producto aumenta la actividad de la enzima disminuye
Hay enzimas regulados por otros ligandos distintos, moduladores de la actividad de la enzima. Se unen a un sitio distinto del centro activo llamado centro regulador, que no poseen todos los enzimas. Los que sí tienen se llaman enzimas alostéricos.
Saturación de la enzima por el sustrato: cuando [S]0,9/[S]0,1 ≈ 80 el cambio en la concentración de sustrato es muy grande y la célula no lo permite. Si la enzima presenta cooperatividad en la unión el cambio es mucho más pequeño ya que será más sensible a los cambios en la concentración de sustrato:
[S]0,9/[S]0,1 ≈ 4. Por lo tanto será muy ventajosa la cooperatividad en la unión del sustrato. Cabe pensar que la proteína será oligomérica y tendrá varios sitios activos.
Dependencia de Kₘ
Si el producto se parece mucho al sustrato puede entrar en el centro activo actuando como un inhibidor competitivo haciendo que Kₘ aumente y Kafinidad disminuya. Hay moléculas que se unen a otro sitio regulador distinto del activo haciendo que la velocidad de la reacción disminuya y Kₘ aumente.
- Los que hacen que Kₘ suba, bajando la velocidad para la misma concentración de sustrato son inhibidores
- Los que hacen que Kₘ baje, aumentando la velocidad para la misma concentración de sustrato son activadores
Con un activador o un inhibidor modificamos la cooperatividad.
Los enzimas reguladores tienen varios centros activos (oligoméricos) con cooperatividad.
Feed-back: el producto final de una serie de reacciones suele actuar como inhibidor del primer enzima uniéndose a un centro regulador. Es una inhibición alostérica. Este sistema no es bueno cuando hay una ramificación en la ruta.
Ejemplo de enzimas alostéricos: aspartato carbamoilasa.
Cataliza la adición:
Asp + Carbamoil-P ⇌ Asp-carbamoil + P
Es la primera reacción de una ruta metabólica. El enzima que actúa es la aspartato carbamoilasa que tiene 12 subunidades de las cuales 6 son catalíticas (organizadas en 2 dímeros) y 6 reguladoras (3 dímeros). Presenta cooperatividad respecto al sustrato (Asp). Está regulada por los niveles de ATP y CTP que son moduladores alostéricos ya que no se parecen a la Asp. El CTP es un inhibidor porque es el producto final de la ruta metabólica e inhibe al primer enzima de la ruta de manera alostérica y Kₘ aumenta. El ATP es una muestra de que hay mucha energía, por lo que se podrán sintetizar muchos ácidos nucleicos y la ruta puede funcionar. Por lo tanto el ATP actúa de activador.
Dependencia de KCAT
v₀ = KCAT·[ES]
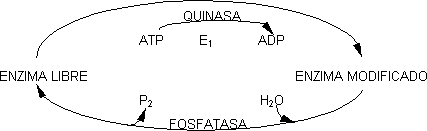
Otra manera de modificar la acción de la enzima es variar el valor de KCAT, cuanto mayor es ésta mayor es la velocidad. Para modificar KCAT hay que cambiar la constante cinética de la reacción. Se la conoce como modificación covalente y es muy efectivo para aumentar la velocidad de la reacción. Modificar covalentemente es cambiar las cadenas laterales de los enzimas, pudiendo existir en dos formas: enzima libre y enzima modificado. esta modificación es reversible. Las dos formas se diferencian en su KCAT, siendo uno mayor que el otro. Normalmente sufren una transferencia de grupo, siendo la más común la de grupos fosfato (fosforilación). Los grupos que se pueden fosforilar son normalmente los OH (Ser, Thr, Tyr). Siempre se requiere la presencia de otro enzima para pasar de libre a modificado o viceversa, aunque los enzimas son diferentes. Para fosforilar se requiere ATP que es el dador de grupos fosfato. La eliminación la produce una reacción hidrolítica. Los enzimas que fosforilan a expensas del ATP son las quinasas y los que hidrolizan el fosfato fosfatasas.
Las reacciones que catalizan E₁ y E₂ son irreversibles y sólo se dan en el sentido que indica el esquema. Una de las formas es siempre activa y la otra inactiva. La forma activa podrá ser las fosforilada o la otra. Para regular la velocidad de la reacción por modificación covalente es imprescindible que sólo se dé una de las dos, esto es, que E₁ y E₂ nunca sean activos al mismo tiempo en las condiciones celulares. Esto se consigue sometiendo a regulación coordinada. Como E₁ y E₂ son enzimas alostéricos el mismo modulador activa a uno e inhibe al otro. El aumento de la velocidad de reacción puede ser mucho mayor que variando Kₘ.
Amplificación de señales
En la regulación de la actividad enzimática puede conseguirse una amplificación muy grande de la señal utilizando cascadas enzimáticas, una serie de enzimas cuya actividad está regulada por modificación covalente y que actúan secuencialmente.
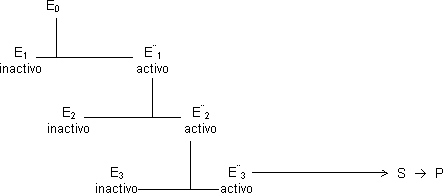
Suponemos que cuando E₀ actúa, 10 moléculas de E₁ se transforman en 10 de E*₁, como también podemos transformar 10 moléculas de E₂ tendremos finalmente 100 moléculas activas de E*₂ y 1.000v de E*₃. Cuantos más pasos demos el factor de amplificación será mejor y sólo tendremos una señal.
Hay otra modificación covalente pero irreversible, lo que implica la ruptura de uno o varios enlaces peptídicos. Ocurre en proteínas que se sintetizan en forma de precursores inactivos que se transforman en proteínas activas más cortas. Todos los enzimas intestinales siguen este modelo, y así se controla el lugar y el momento de la activación.
Existen cascadas de modificación covalente irreversible formadas únicamente por proteasas. La coagulación de la sangre sigue este modelo, la señal inicial es la ruptura de un tejido y el precursor será el fibrinógeno.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).