Cadenas respiratorias
Hay 2 tipos de cadenas de transporte electrónico:
- A favor de potencial de reducción con ΔG < 0. La energía se utiliza para crear μH ⟶ cadena respiratoria
- En contra de potencial de reducción, no espontáneo, ΔG > 0. Aporte de energía. La energía de la luz da lugar a reacciones que crean μ ⟶ cadena de transporte fotoelectrónico. Asociado a la fotosíntesis
La cadenas pueden localizarse:
- Membrana interna de la mitocondria (eucariotas). En las bacterias que respiran en la membrana plasmática
- En el cloroplasto en la membrana tilacoidal. Bacterias fotosintéticas en la membrana plasmática
Glucosa: C₆H₁₂O₆. Cualquier célula la degrada de 2 maneras:
• Fermentación: La glucosa no se degrada completamente porque no se oxida sino que se crean 2 moléculas más pequeñas (de 3 carbonos). Se crea lactato en la fermentación láctica y etanol en la alcohólica. La fermentación no requiere oxígeno. ΔG < 0 = -217 KJ/mol
• Degradación completa hasta CO₂. Se necesita la ayuda del O₂:
C₆H₁₂O₆ + 6·O₂ ⟶ 6·CO₂ ΔG < 0 = -2.810 KJ/mol
No se produce la combustión completa de la glucosa en una sola reacción sino que se hace en muchas etapas liberando energía en porciones utilizables.
Cadena respiratoria
Los e⁻ procedentes de las oxidaciones de la célula vendrán formando parte del NADH y FADH₂ que los cederán al O₂ debido al Eco (potencial de reducción) que es más positivo cuanto mayor es la tendencia a captar los e⁻. Ceder los e⁻ al O₂ es favorable. La cesión de O₂ ocurre en varios pasos de oxidación reducción, por eso es una cadena, Tendremos pequeñas porciones de ΔG que se usarán para sintetizar ATP pero no directamente. La cadena respiratoria está siempre en una membrana y almacena la energía en forma de gradiente de concentración. Este gradiente es el que se encarga de sintetizar el ATP, En la misma membrana deberá haber ATP sintasa que aproveche el bombeo de H⁺. Se sintetiza ATP en el lado donde haya menor concentración de H⁺
Transportadores
Flavoproteínas
Proteínas que tienen grupo prostético derivado de la flavina, FAD ó FMN. Pueden transportar 2 e⁻ y 2·H⁺ a la vez, es decir, moléculas de H₂
Metaloproteínas.
Hemoproteínas (citocromos)
El Fe transporta los e⁻ y forma parte del grupo hemo. El Fe puede ser Fe²⁺ o Fe³⁺. Los citocromos pueden transportar los e⁻ de 1 en 1. Presentan color porque absorben luz visible, color distinto si la forma es la reducida o la oxidada. Varios tipos de citocromos: a, a₃, b, c, c₁, d y o. Los d y o son específicos de determinas cadenas respiratorias. El hemo del citocromo b es igual al de la hemoglobina, la diferencia funcional está en la cadena polipeptídica. Grupo hemo unido covalentemente a la proteína (citocromo c, a residuos de C₄) o no (restantes). Menos el c todas las demás son proteínas internas de membrana.
Ferrosulfuradas
El Fe no forma parte del grupo hemo, en su lugar hay centros ferrosulfurados. Hay 2 tipos: Fe₂S₂ y Fe₄S₄. Los FeS están unidos a 4 S de las cisteínas. Transporte de e⁻ de 1 en 1.
Quinonas
Unico transportador no asociado a proteínas. En los mamíferos tiene 10 subunidades de isopreno y se le llama ubiquinona. Soluble en el entorno hidrofóbico de la membrana. Puede aceptar 2 e⁻ y 2·H⁺, estará reducida u oxidada. Si acepta los e⁻ de 1 en 1 se llama semiquinona.
Organización y funcionamiento de la cadena respiratoria
Muchos componentes, alguno de ellos organizados en complejos. Todas las cadenas tienen siempre transportadores organizados en complejos y otros móviles que unen los anteriores. Los móviles son la UQ y el cit c. Los e⁻ se transfieren de un complejo a otro por choque. Transporte siempre organizado a favor de un E°. El punto por donde los e⁻ se incorporan no es siempre el mismo, depende del E° ya que ha de ser favorable. El NADH tiene más tendencia a ceder los e⁻ que el FADH₂ por lo que se obtendrá más energía cuando se oxide el NADH que cuando lo haga el FADH₂. Cuando los e⁻ los aporta el NADH se incorporan al principio de la cadena y participan 3 complejos:
![]()
Este proceso no se puede variar ya que están ordenados atendiendo a un E° cada vez más +.
El FADH₂ no se une por el mismo sitio sino que lo hace a través del complejo II, de ahí los cede a la UQ y a partir de entonces es todo igual,
El ascorbato también se une por otro sitio y lo hará a partir del cit c.
Orientación en la membrana y bombeo de H⁺
Los e⁻ que llegan a la cadena siempre lo hacen desde el interior de la mitocondria, es decir, el NADH está en la matriz mitocondrial. Cuando los e⁻ se transfieren desde el NADH hacia el O₂, que también está en el interior de la mitocondria, los H⁺ se bombean hacia el espacio intermembranoso, hacia el exterior de la mitocondria. La ATP sintasa estará en esa posición y el ATP se sintetiza en el interior de la mitocondria. Cuando los e⁻ pasan por estos complejos se bombean H⁺ creando un gradiente (almacén de energía). Los transportadores tienen un nombre en función de la acción que realizan. Todos catalizan reacciones redox.
Complejo I: oxida el NADH y reduce UQ ⟶ NADH - UQ - reductasa.
Complejo III: UQ - cit c - reductasa.
Complejo IV: cit c - oxidasa.
Complejo II: recoge los e⁻ que vienen del FADH₂ y que proceden siempre del ciclo del ácido cítrico. Como es el succinato, succinato - UQ - reductasa.
Estos complejos tienen todos varios transportadores de electrones:
Complejo I: FMN y centros FeS.
Complejo II: FAD, centros FeS y 1 cit b.
Complejo III: centros FeS y citocromos b y c₁.
Complejo IV: cit a, cit a₃ e iones de Cu.
El transporte dentro de un complejo también está organizado a favor de E° y siempre el que coja los e⁻ tendrá E° más positivo que el que los cede.
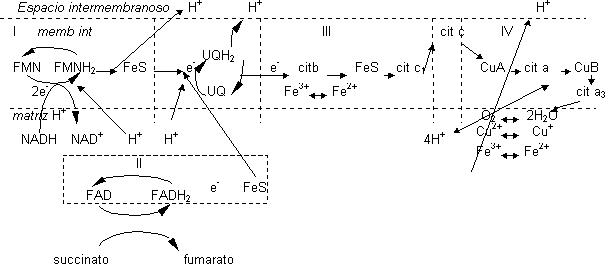
Los 2·e⁻ son recogidos por el FMN del complejo I que pasa a la forma reducida FMNH₂, cogiendo para ello 1·H⁺ de la matriz. Los e⁻ del FMNH₂ pasan a un FeS que los transporta de 1 en 1 quedando dos H⁺ libres que pasan al espacio intermembranoso. Los e⁻ saldrán del complejo I por el FeS pasando a la UQ que es capaz de transportar 2·e⁻ y 2·H⁺. Coge los 2·H⁺ del medio que le hacen falta para reducirse a UQH₂. El paso de los e⁻ por el complejo I provoca un bombeo de H⁺ desde el interior de la mitocondria. Esta UQ cede los e⁻ al complejo III donde sólo se transportan e⁻. El primer componente que actúa es el cit b y la UQ le va dando los e⁻ de 1 en 1. El cit b recoge os e⁻ en el Fe del hemo que pasa de Fe³⁺ a Fe²⁺ y los cederá a un FeS quedando de nuevo en estado Fe³⁺. Del FeS pasa al cit c₁ que lo pasa al cit c que está fuera del complejo III y además está en la superficie. Este cit c los pasa al complejo IV cediéndoselos al CuA, cit a. CuB y finalmente el cit a₃, que se los cede al O₂. El complejo IV actúa como una bomba de H⁺ que funciona gracias a la energía obtenida por las reacciones redox. Estos H⁺ provienen de las cadenas de los aminoácidos que se disocian. La formación de H₂ o requiere e⁻ y H⁺ que coge de la matriz mitocondrial.
Cada vez que el NADH se reoxida cede 2 e⁻ por lo que sólo es capaz de reducir 1 átomo de O₂, se necesita que lleguen 4 e⁻ a la vez. Existen mecanismos que explican cómo la célula recoge 4 e⁻ a la vez para que el O₂ no se vaya reduciendo poco a poco a partir de especies intermedias. Hasta que no tiene 4 e⁻ juntos no se reduce para dar 2 moléculas de H₂O.
Los e⁻ que entran por el FAD provienen del ciclo de Krebs a partir del succinato que se encuentra en la matriz mitocondrial, Este succinato da lugar al fumarato mediante la pérdida de 2·H⁺ que recoge el FAD dando lugar al FADH₂. Los e⁻ pasarán a un FeS y de ahí a la UQ. En el complejo II no existe bombeo de H⁺
Síntesis de ATP
Para bombear H⁺ se tiene que utilizar energía que proviene de las reacciones redox. Para la síntesis de ATP hay que tener en cuenta la relación P/O (n° de moléculas de ATP que se sintetizan cada vez que se consume un átomo de O₂ o que se transportan 2 e⁻ por la cadena). Según el nivel en el que están los e⁻ la relación P/O será mayor o menor. Se ha comprobado que cuando los e⁻ son aportados por el NADH la relación P/O = 3. Si no hubiera cadena de transporte electrónico no se reoxidarían los coenzimas y no se podrían volver a utilizar. Cuando los e⁻ los aporta el FADH₂ P/O = 2 y cuando es el ascorbato P/O = 1.
![]()
Entonces hay 3 sitios donde se conserva la energía (I, III, IV) pero no se sintetiza ATP en estos sitios. Como el complejo II no crea ningún gradiente de H⁺ no se conserva la energía.
Este proceso está regulado porque para que haya síntesis de ATP tiene que funcionar la cadena de transporte electrónico para crear gradiente de H⁺. Además, si la célula no sintetiza ATP porque no lo necesita no habrá cadena de transporte electrónico porque no se podrán reoxidar los coenzimas. Para que se dé la síntesis necesitamos NADH, O₂, ADP y Pi, siendo el ADP el que controla la velocidad de la cadena de transporte electrónico (control respiratorio).
Control respiratorio
Al aumentar la concentración de ADP aumenta la velocidad de la cadena de transporte electrónico y viceversa. Se puede explicar desde 2 puntos de vista:
Físico - químico: si no hay ADP no hay síntesis de ATP, no se consume gradiente de protones por parte de la ATP sintasa. Si sigue funcionando la cadena de transporte electrónico el gradiente es cada vez más grande, se llega a un punto en el que la energía para bombear H⁺ es muy grande y la cadena de transporte electrónico se para porque no puede proporcionar bastante energía para seguir bombeando. Disminuye el consumo de O₂
Fisiológico: si baja la concentración de ADP es porque hay mucho ATP y a la célula no le interesa sintetizar más, si la cadena de transporte electrónico no funciona los coenzimas no se reoxidan y todos los procesos se paran. Al aumentar la concentración de ADP se pon en marcha la cadena de transporte electrónico, todos los procesos se activan y se crea gradiente de H⁺ para la síntesis de ATP.
Inhibición del transporte electrónico (síntesis de ATP)
Hay 2 tipos de inhibidores que inhiben la cadena de transporte electrónico y la síntesis de ATP.
Inhibidores de la cadena.
Se han descrito inhibidores específicos para cada uno de los complejos de la cadena.
- Complejo I: rotenona y amitol
- Complejo II: malonato
- Complejo III:
- Complejo IV: cianuro, CO y azida
Si se bloquea la cadena de transporte electrónico cesa el consumo de O₂. Estos inhibidores han sido importantes para determinar el orden de los complejos en la cadena de transporte electrónico. Si no hay consumo de O₂ no habrá gradiente de H⁺ y no se sintetizará ATP.
Inhibidores de la síntesis de ATP
El inhibidor de la ATP sintasa es la oligomirina, que bloque la cadena y la síntesis de ATP.
Desacopladores: otras moléculas inhiben la síntesis de ATP desacoplándola de la cadena de transporte electrónico, y aunque no haya síntesis la cadena sigue funcionando. Un desacoplador deshace el gradiente de H⁺ sin parar la cadena. El más común es el 2,4-dinitrofenol que es soluble en la membrana y su grupo oh se puede disociar. Esto libera energía en forma de calor. Tanto el ATP como el ADP necesitan un transportador para salir y entrar de la matriz mitocondrial y este transporte está favorecido por el gradiente de H⁺. En la membrana interna de la mitocondria hay un transportador que a la vez que saca atp mete ADP + Pi y esto está dirigido por el potencial de membrana. Los Pi entran gracias a un transportador que se mueve por un gradiente de concentración. Este transportador cotransporta H⁺ y Pi y aprovecha la energía del gradiente para a la vez que se introduce H⁺ introducir Pi. Los desacopladores pueden ser fuente de calor para aumentar la temperatura de la célula. Esto es utilizados por neonatos y animales que hibernan. A esta proteína desacopladores se le llama termogenina.
Otras cadenas de transporte de electrones
En bacteria, donde no ha mitocondrias, las cadenas residen en la membrana plasmática y funcionan esencialmente con el mismo tipo de moléculas pero son más cortas y más eficientes. No todas utilizan como aceptor final de e⁻ el O₂. Serán cadenas anaerobias donde el aceptor final puede ser un compuesto de S ó N. Esta membrana plasmática también tendrá ATP sintasa.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).