El acetil-CoA
El acetil-CoA es un producto común a todas las reacciones de degradación de todas las moléculas orgánicas. Una ruta metabólica nunca está separada de las demás.
Estructura
∘ Resto acetilo: restos de 2 carbonos (C₂) que proceden de la degradación de las moléculas. Siempre asociado a la segunda parte
∘ CoA: coenzima descubierto por Lipman. Transportador universal de grupos acetilo y también de cadenas más largas. Estos restos se unen al CoA por medio de un enlace tioéster
Cuando el grupo acetilo tenga que tomar parte en una reacción de transferencia deberá estar unido al CoA. La parte más importante es el grupo sulfhidrilo que es por donde se unen los restos al acetil-CoA. La formación del enlace es importante porque la ruptura libera mucha energía. Su ΔG es tan negativa como la hidrólisis del ATP. Tiene una gran importancia en la transferencia de grupos acetilo. el grupo acetilo está activado y es muy fácil transferirlo cuando forma parte del CoA. Como libera la misma cantidad de energía al romperlo, tendré suficiente energía para formar ATP.
![]()
El acetil-CoA procede de cualquier sustancia o molécula que degrademos para obtener energía.
∘ Lípidos ⟶ n ácidos grasos ⟶ n/2 acetil-CoA
∘ Hidratos de carbono ⟶ acetil-CoA (siempre a través de la glicolisis) H de C ⟶ glicolisis ⟶ piruvato ⟶ acetil-CoA
∘ Proteínas ⟶ aminoácidos ⟶ glicolisis ⟶ piruvato ⟶ acetil-CoA ⟶ acetil-CoA
Destinos del acetil-CoA
- El resto acetilo se puede oxidar completamente dando dos CO₂ y el CoA no se oxida. Para ello el acetil-CoA entra en el ciclo de Krebs produciéndose la oxidación completa
- Puede formar ácidos grasos cuando se unen varios acetil-CoA y formarán componentes de membrana (ácidos grasos)
- Puede utilizarse para sintetizar colesterol
- También se puede usar para formar cuerpos cetónicos en condiciones especiales del metabolismo. Estos cuerpos cetónicos pueden usarse como sustratos energéticos. El único que no puede usar esta fuente de energía es el hígado
- Sólo en algunos casos se podrá utilizar para crear hidratos de carbono (semillas y microorganismos). Para ello hace falta tener el ciclo del glioxilato
El ciclo de Krebs
El acetil-CoA es un resto de 2 carbonos unido al CoA. Estudiaremos la oxidación completa hasta 2 moléculas de CO₂ el acetato es difícil de oxidar, por lo que se une a otro compuesto por condensación.
![]()
Para que sea rentable la oxidación el aceptor debe regenerarse por sí mismo en el ciclo de Krebs. En eucariotas, en la mitocondria, siempre se hace el ciclo del ácido cítrico (C.A.C.). En este ciclo sólo se oxida el acetil-CoA. Hay 3 etapas (así se obtiene más energía):
Entrada del acetato
El C₄ es siempre el oxalacetato:
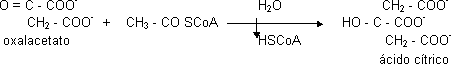
Es una reacción de condensación favorecida por la ruptura del enlace tioéster, la enzima participante es la citrato sintasa. La hidrólisis es para que se libere el CoA. Reacción irreversible, es un punto de control importante del C.A.C.
Descarboxilaciones oxidativas
La concentración de oxalacetato es muy pequeña en la célula. El ácido cítrico es una molécula simétrica en donde el alcohol es terciario. Como es difícil de oxidar se transforma en un alcohol primario más fácil de oxidar.
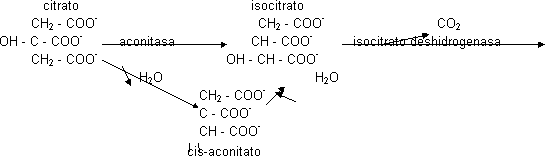
Este alcohol secundario sufrirá la primera descarboxilación y los e⁻ los recogerá el poder reductor, en este caso el NAD⁺ ya que será dependiente del isocitrato. Se obtiene un C₅ que es el α -oxoglutarato. lo que primero se hace es la eliminación de los e⁻ (NAD+ ⟶ NADH) y luego se produce la descarboxilación. esta reacción en condiciones celulares tiene ΔG < 0, también será punto de control. Este C₅ se vuelve a descarboxilar de manera oxidativa, obteniéndose NADH y la segunda molécula de CO₂. Como también tiene ΔG < 0 será punto de control. La α-glutarato deshidrogenasa va a necesitar muchos cofactores porque es un complejo enzimático con 3 actividades distintas.
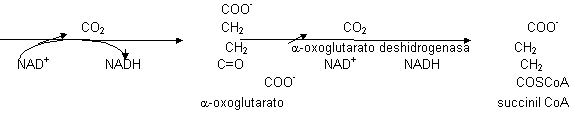
El α-oxoglutarato es igual al piruvato en cuanto a funcionamiento (ver glicolisis). La succinil CoA es un derivado del succinato. Se forma un enlace tioéster llamado ricoenergético. cuando se rompe libera mucha energía, la suficiente para dirigir la síntesis de ATP:
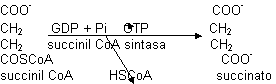
El enzima requiere GTP en lugar de ATP. A partir de GTP puede obtenerse ATP mediante la nucleodifosfo quinasa. Es el único paso en que se obtiene ATP de manera directa. Esta síntesis es fosforilación a nivel de sustrato y no a través de la cadena de transporte electrónico. Este succinato tiene que volver a transformarse en oxalacetato (regenerar el aceptor
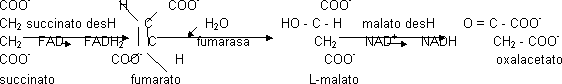
Regeneración del aceptor
El succinato en un primer paso se oxidará dando fumarato. El FAD es un coenzima. La succinato deshidrogenasa es el único enzima no soluble ya que es una vía de entrada de e⁻ en la cadena respiratoria formando parte del complejo II. Este enzima siempre forma el isómero trans. La succinato deshidrogenasa tiene un inhibidor competitivo, el malonato. El fumarato se hidratará formándose sólo uno de los compuestos posibles. El paso catalizado por la malato deshidrogenasa tiene ΔG > 0, aunque se da porque la concentración de oxalacetato es muy pequeña.
Balance energético del ciclo de Krebs:
Acetil-CoA + GDP + Pi + 3·NAD⁺ (1) + FAD + 2·H₂O (2) ⟶ 2·CO₂ + HSCoA + GTP + 3·NADH + FADH₂
(1) Para que funcione el ciclo es obligatorio que esté oxidado.
(2) Isomerasa, citratosintasa.
El ciclo de Krebs es dependiente del O₂ ya que éste recibe los e⁻ que vienen del NADH y FADH₂ para poder regenerar NAD⁺ y FAD. Dentro de la mitocondria, donde está la cadena de transporte electrónico, es donde se regeneran los cofactores.
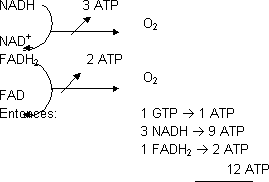
Cada vez que se oxida una molécula de acetil-CoA se obtienen 12 ATP, de los cuales sólo 1 se obtiene directamente y los otros 11 a través de la ATP sintasa.
Regulación
Los puntos de control están siempre en los pasos irreversibles. La carga energética es un punto de regulación porque si es alta el ciclo de Krebs funciona de manera más lenta. Si es baja (mucho ADP) funcionará más rápido. Hay 3 enzimas que reglan el ciclo:
Citratosintasa
Su actividad depende de la concentración de 2 sustratos como el acetil-CoA y la succinil CoA. La succinil CoA inhibe porque ocupa el sitio del acetil-CoA. Si la concentración de succinil CoA sube mucho se inhibe, si sube es porque se acumulan los intermediarios. El ATP también inhibe porque al aumentar su concentración la km sube.
Isocitrato deshidrogenasa
Está inhibida por niveles altos de ATP y NADH, activado por ADP y NAD+. El ADP hace que aumente la afinidad por el sustrato.
α-oxoglutarato deshidrogenasa.
Inhibido cuando los niveles de NADH son altos y cuando aumenta la concentración de succinil CoA, ya que ambos son productos. También regulado por la carga energética.
Carácter anfibólico del C.A.C. y reacciones anapleróticas
Carácter anfibólico significa que participa tanto en el catabolismo como en el anabolismo. Hay 4 intermediarios que se pueden usar para otras cosas:
• α-oxoglutarato: por medio de una reacción puede dar lugar a 2 aminoácidos, Gly y Asp
• Oxalacetato: reacción de transaminación con 2 sustratos:
Oxoácido₁ + aminoácido₂ ⇔ aminoácido₁ + oxoácido₂
• Succinil CoA: precursor de la síntesis de porfirinas que son la base de los grupos hemo
• Citrato: participa en la síntesis de ácidos grasos
Si se gastan los intermediarios disminuye su concentración y se ralentiza el ciclo porque cada vez se gastará menos acetil-CoA, ya que cada vez se regenera menos oxalacetato. Para reponer estos intermediarios están las reacciones anapleróticas.
• Una forma de reponerlos son las reacciones de transaminación con Gly y Asp
• Otra reacción sería:
Piruvato + CO₂ + ATP ⟶ oxalacetato + ADP + Pi
Piruvato carboxilasa.
La piruvato carboxilasa es un regulador muy importante porque puede reponer los niveles de oxalacetato. Para carboxilar se necesita un coenzima, la biotina. Si los niveles de acetil-CoA son altos es porque no se puede meter bien en el ciclo de Krebs ya que falta oxalacetato. De esta forma se activa la piruvato carboxilasa para poder obtener oxalacetato.
Ciclo del glioxilato
Esta es otra reacción anaplerótica. Es una forma modificada del C.A.C. y permite obtener uno de los intermediarios: 2 acetil-CoA ⟶ 1 succinato. Sólo existe en semillas y algunos microorganismos. Sólo los que tengan el ciclo del glioxilato podrán sintetizar hidratos de carbono a partir de lípidos.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).