Química técnica
Conceptos previos
La química orgánica e inorgánica caracterizan una serie de compuestos, estudiando las reacciones que tienen lugar entre ellos. Intentar sintetizar estos compuestos sin saber si va a tener una utilidad inmediata para el hombre.
La químicofísica investiga leyes generales de comportamiento de la materia de modo que puedan aplicarse a un gran número de compuestos pero sin conceder importancia a la aplicación inmediata de dichos compuestos.
La química técnica se sustenta sobre las otras tres. A partir de estas tres bases (orgánica, inorgánica y quimicofísica) enuncia leyes basadas en principios físicos y químicos que sean de una utilidad inmediata a la química industrial. Introduce procedimientos de diseño de las diversas operaciones que tienen lugar en una planta química mediante un mayor conocimiento de los fenómenos físicos y químicos que tienen lugar en el proceso con el objetivo de provocar la realización de productos de un mayor valor económico. Mejorar técnicas de trabajo y desarrollar procesos para economizar tiempo y costos.
A nivel industrial los productos químicos se clasifican:
1) Compuestos químicos de base:
Son sustancias que se producen directamente a partir de materias primas por simple purificación o por transformaciones muy simples realizadas a gran escala:
∘ Se producen en gran cantidad
∘ Con características iguales para todos los fabricantes
Como por ejemplo: H₂SO₄, NH₃, cloro, etileno, pasta de celulosa …
Estos compuestos sufren una transformación
2) Compuestos intermedios:
El número no es excesivamente elevado. No se utilizan directamente por el consumidor. La calidad sí depende del fabricante que lo sintetice
3) Compuestos terminados:
Se sintetizan en industrias transformadoras. Cada fabricante le da unas características finales aunque algunos todavía no son válidos para los consumidores y sufren una adición de compuestos o una manipulación para su posterior consumo
Vamos a estudiar una cadena de transformaciones del NH₃: La materia prima del nitrógeno es el aire y la del hidrógeno es el petróleo. A partir del amoníaco obtenemos el ácido nítrico y con este fabricamos los abonos nitrogenados.
Otra serie es la del etileno el cual se obtiene al destilar el petróleo, o a partir de la destilación del gas natural. Del etileno llegamos al óxido de etileno y al cloruro de etileno que sirve para fabricar plásticos de policloruro de vinilo (P.V.C.).
Los productos farmacéuticos proporcionan un alto rendimiento económico gracias a su gran especificidad y pequeña producción.
Ingeniería Química: objetivos principales
"Ciencia que concibe, proyecta, hace construir, hace funcionar las instalaciones donde se puedan llevar a cabo una reacción química a nivel industrial, o bien, una operación de separación inmediata". Cathala.
Pretende un cambio de escala del nivel de laboratorio a nivel industrial. Intenta dividir los procesos globales en pequeños procesos que se repiten mecánicamente dando las operaciones unitarias.
Cinética
Es la parte de la química-física que estudia la velocidad de las reacciones y la trayectoria para llegar de los reactivos a los productos. La velocidad de reacción se da en unidades de mol/l·s (concentración/unidad de tiempo).
Al trabajar con moléculas gaseosas podremos utilizar unidades como presión/unidad de tiempo.
Para reacciones generales:
a·A + b·B ⟶ c·C + d·D
La velocidad de esta reacción podrá ser de desaparición de la especie A o B o bien de aparición de las especies C o D.
| vA = - | dA |
| dt |
Signo negativo debido al criterio de que la velocidad de desaparición es negativa.
| vB = - | dB |
| dt |
| vC = | dC |
| dt |
| vD = | dD |
| dt |
En general:
| v = - | 1 | · | dA | = - | 1 | · | dB | = | 1 | · | dC | = | 1 | · | dD |
| a | dt | b | dt | c | dt | d | dt |
Pero la velocidad de una reacción se expresa más generalmente como:
v = k·[A]·[B]
k: constante de velocidad es numéricamente igual a la velocidad de la reacción si la concentración de los reactivos es igual a 1. Físicamente indica la influencia numérica que tienen la temperatura y la naturaleza de los reactivos en la reacción que estemos estudiando.
y: órdenes de reacción. Son números de factores de concentración de los que depende la velocidad de la reacción. No se pueden predecir, son experimentales.
Suponiendo [A] = 1 y [B] = 1 diremos entonces que la reacción es de orden 1 con respecto al reactivo A y de orden 1 con respecto al reactivo B. El orden de la reacción será la suma de los órdenes de los reactivos (en este caso el orden de la reacción es 2). Los órdenes no tienen por qué ser enteros, también pueden ser funciones e incluso se dan los órdenes negativos. A diferencia de esto, la k podrá ser todo lo pequeña que queramos pero jamás será negativa.
Las unidades de "k" vendrán dadas en función del orden global de la reacción que estamos estudiando.
Para determinar y empleamos el método de las velocidades iniciales donde mantengo la [B] y [C] y varío la de A para calcular. Si varío [A] y mido la velocidad al principio de la reacción nada más mezclar los reactivos, entonces obtengo la influencia de la [A] en la velocidad de reacción. De esta manera tengo. Operando análogamente podemos obtener en los demás casos y.
Métodos experimentales empleados para determinar la velocidad de reacción
Los métodos experimentales se dividen básicamente en dos grandes grupos:
a) Métodos Químicos
b) Métodos Físicos
Los métodos químicos presentan varios incovenientes:
Son destructivos. Ejemplo: valoración ácido-base.
Hay competencia de reacciones. Para evitar este fenómeno debemos congelar la reacción y para ello hay dos posibilidades: bajar la temperatura y añadir más líquido.
Los métodos físicos se basan en seguir la variación de alguna propiedad física que esté directamente relacionada con la concentración de la especie en el tiempo. Ejemplo: en gases; análisis de la presión, polaridad, espectros …
Factores que influyen en la velocidad de una reacción
1) Naturaleza de los reactivos (enlaces, grupos funcionales …)
2) Concentración de las especies reactivas
3) Temperatura
4) Grado de disgregación de los reactivos
5) Presencia de catalizadores (factor fundamental), tanto para acelerar como para retardar la reacción. Un catalizador no consigue que se realice una reacción que no se da
Influencia de la concentración en la velocidad de reacción
Vamos a ver las ecuaciones que rigen la velocidad de la reacción en relación con las concentraciones de los reactivos.
Si la concentración no influye para nada hablaremos de reacciones de orden cero. Estas reacciones son poco frecuentes pero hay un grupo de reacciones que son las descargas de gases sobre superficies metálicas (fenómeno en el que se basan las bombillas). Independientemente de la concentración del gas será la velocidad de desaparición del metal siempre y cuando la superficie del metal esté completamente cubierta de gas.
Reacciones de orden cero
| v = - | dC | = k·C ⟶ = 0 ⟶ - | dC | = k |
| dt | dt |
C₀: concentración inicial de la especie
C: concentración actual de la especie
C₀ - C = k·t ⟶ C = C₀ - k·t
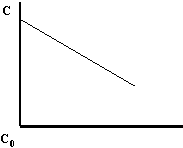
Gráfica de una reacción de orden 0.
Definimos el tiempo de semidescomposición como el tiempo necesario para reducir a la mitad la cantidad inicial de la especie.
| C₀ | = C - k ⟶ | C₀ |
| 2 | 2·k |
Reacciones de orden 1
Generalmente es el caso más corriente.
Ejemplo: Descomposición del N₂O₅
| v = - | dC | = k·C¹ = k·C |
| dt |
ln C = ln C₀ - k·t (pendiente de la recta es la k de la v)
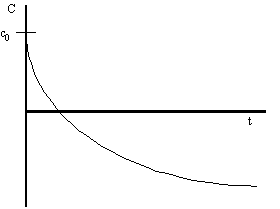
C = C₀·e⁻k·t
El tiempo de semidescomposición:
| ln | C₀ | = ln C₀ - k = ln | 2 |
| 2 | k |
En una reacción de primer orden el tiempo de descomposición es independiente de la concentración inicial.
Ejemplo: todas las reacciones nucleares de descomposición.
Influencia de la temperatura en la velocidad
Antiguamente se había visto que la velocidad de una reacción aumenta a medida que aumentaba la temperatura. Fue Svante August Arrhenius el primero que encontró una ecuación que relacionaba las constantes de velocidad y la temperatura. Encontró que la velocidad cumplía que:
| log k = f· | 1 |
| T |
Expresado en grados kelvin. De estos datos empíricos llegó a:
K = A·e⁻Ea/R·T
A: factor de frecuencia. Nos mide el número de choques que existen entre los reactivos cuando tenemos 1 mol de dichos reactivos por cm² (tiene las mismas unidades que K). Esta idea sobre A está basada en la teoría de colisiones que nos decía cómo se comportaban las moléculas chocando en distintas direcciones lo que provoca una variación en la velocidad de reacción.
Ea: Para explicar el significado de esta magnitud recurrimos a la teoría del complejo activado en el que cobra gran importancia la energía de las moléculas. Sólo aquellas moléculas con una determinada energía (energía de activación) serán capaces de sufrir la reacción. Cuanto más alta sea la energía de activación menos moléculas conseguirán alcanzarla, y por ello menos moléculas sufrirán la reacción.
A medida que aumenta la temperatura la E a del proceso será alcanzada por más moléculas por ello la velocidad de su reacción será mayor.
Catalizadores
Son sustancias que varían la velocidad de la reacción. Normalmente los catalizadores son aceleradores de la velocidad, pero también en algunos casos los catalizadores retardan la reacción. La función de los catalizadores es modificar la forma de pasar de los reactivos a los productos, pero los catalizadores nunca consiguen que se de una reacción que anteriormente no se daba.
Características de los catalizadores:
- Una pequeña cantidad de catalizador, puede catalizar mucho reactivo
- En principio no se consumen
Según en el estado de agregación en que se encuentren con relación al reactivo los dividiremos en:
1. Catálisis homogenea: Cuando el catalizador y el reactivo se encuentran en el mismo estado de agregación. Es la catálisis menos frecuente, un ejemplo puede ser la descomposición del agua oxigenada.
1) 2·H₂O₂ ⇌ 2·H₂O + O₂ muy lenta.
Para acelerar esta reacción añadiremos I⁻:
| 2) | H₂O₂ + I⁻ | ⇌ H₂O + IO⁻ |
| 3) | H₂O₂ + IO⁻ | ⇌ H₂O + O₂ + I⁻ |
| 2·H₂O₂ | ⇌ 2·H₂O + O₂ |
El catalizador cumple su función y luego se regenera, lo que ocurre es que aumenta la velocidad en las reacciones consecutivas 2 y 3, y por tanto acelera la reacción global 1.
2. Catálisis heterogenea: El catalizador se encuentra en distinto estado de agregación que los reactivos. Este tipo de catálisis se utiliza mucho en ingeniería química ya que los reactivos suelen ser gases o reactivos en disolución y el catalizador suele ser un sólido.
Ejemplo: hidrogenación de dobles enlaces. La catálisis se favorece adicionando catalizadores sólidos como platino o paladio. La presencia de paladio fija las posiciones del doble enlace (alqueno) y por otra parte favorece la ruptura del enlace de la molécula de H₂ con lo cual se obtienen átomos de hidrógeno que hacen que la velocidad de la hidrogenación aumente.
3. Autocatálisis: uno de los productos de la reacción sirve como catalizador de la reacción.
2·MnO₄⁻ + 5·C₂O₄⁼ + 16·H⁺ ⟶ 10·CO₂ + 8·H⁺ + 2·Mn²⁺
La formación de más Mn²⁺ aumenta la velocidad de la reacción.
4. Catálisis bioquímica: constituyen los catalizadores conocidos como enzimas, sin su presencia no se darían las reacciones biológicas de la vida.
Mecanismos de reacción
Cuando hablamos de procesos químicos en una reacción, esta reacción se suele dar en varios procesos elementales para pasar de reactivos a productos.
2·A + B ⟶ C + D
V = K·[A]²·[B]
Tendremos que hablar de molecularidad de la reacción, que nos indica el número de moléculas que intervienen en la reacción es equivalente a la lentitud. Para esta reacción diríamos que es trimolecular ya que tienen que reaccionar tres moléculas.
Nosotros podemos proponer:
2·A ⟶ A₂
A₂ + B ⟶ C + D
Estas son etapas consecutivas. Nosotros tenemos que intentar aislar la especie que proponemos, en este caso la especie A₂. Si no podemos aislarlo tendremos que detectarlo mediante métodos físicos o químicos y si tampoco podemos detectarlo hemos de llegar a que la especie A₂ es una especie inestable. Tenemos que detectar cual de las dos etapas es la determinante de la reacción que será aquella que sea más lenta de todas. Suponemos que sea la etapa 1, de manera que la velocidad sería:
V = K·[A]² no equivale a la obtenida experimentalmente
Ahora suponemos que la más lenta es la segunda lo que indica que la velocidad sería:
V = k·[A₂]·[B] vemos que [A₂] no aparecía en la experiencia obtenida experimentalmente por ello la pondremos en función de los reactivos.
2·A ⟶ A₂
A₂ ⟶ 2·A Tendríamos este equilibrio dinámico A₂ ⇌ A₂
Tenemos velocidad directa y velocidad inversa y en equilibrio dinámico Vd = Vᵢ
Vd = K·[A]²
Kd·[A]² = Kᵢ·[A₂]
Vᵢ = K·[A₂]
| Kd | ·[A]² = [A₂] |
| Kᵢ |
Si sustituimos en la expresión de la velocidad experimental
| V = K· | Kd | ·[A]²·[B] |
| Kᵢ |
Esto significa que el mecanismo que proponemos se ajusta a lo que teníamos por ello es factible pero no estamos seguros de que sea el mecanismo real ya que puede haber otros mecanismos que nos den el resultado obtenido experimentalmente.
Tenemos que intentar aislar, identificar la especie sobre la que hemos trabajado.
Bibliografía:
- Principios básicos de los procesos químicos. Felder R.M. y Rousseau R.W. Editorial Adisson-Wesley.
- Principios y cálculos básicos de la Ingeniería Química. Himmelblaw D. Editorial CECSA.
- Ingeniería Química. vol.I Conceptos generales. Costa Novella E. y col.
- Introducción a la Química Industrial. Vian A. Editorial Reverté.
- Problemas de balances de materia. Primo Stivalent R. y Valiente A. Editorial Alhambra.
Editor: Ricardo Santiago Netto (Administrador de Fisicanet).