Problema nº 7 de entalpía de formación, calor de formación de una reacción por etapas - TP04
Enunciado del ejercicio nº 7
Calcular el calor de formación de la reacción:
CO + ½·O₂⟶ CO₂
Pasando por estas ecuaciones:
a) C + ½·O₂⟶ CO (ΔH = -26,395 kcal/mol)
b) C + O₂⟶ CO₂ (ΔH = -93,973 kcal/mol)
Desarrollo
Datos:
ΔHCO = -26,395 kcal/mol
ΔHCO₂ = -93,973 kcal/mol
Solución
Planteamos los pasos teniendo en cuenta que la entalpía de los reactantes es cero debido a que son moles de sustancias puras (entalpía de elementos = 0).
a)
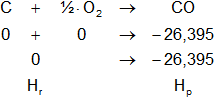
Planteamos la ecuación:
ΔH = Hₚ - Hᵣ
Reemplazamos por los datos y calculamos:
ΔH = -26,395 kcal/mol - 0 kcal/mol
ΔH = ΔHCO = -26,395 kcal/mol
b)
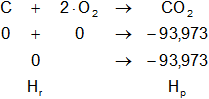
Planteamos la ecuación:
ΔH = Hₚ - Hᵣ
Reemplazamos por los datos y calculamos:
ΔH = -93,973 kcal/mol - 0 kcal/mol
ΔH = ΔHCO₂ = -93,973 kcal/mol
c) Empleando los calores de formación de los pasos anteriores planteamos la solución de la reacción dada:
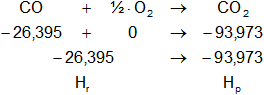
Planteamos la ecuación:
ΔH = Hₚ - Hᵣ
Reemplazamos por los datos y calculamos:
ΔH = -93,973 kcal/mol - (-26,395 kcal/mol)
ΔH = -93,973 kcal/mol + 26,395 kcal/mol
ΔH = -67,578 kcal/mol
Respuesta: la entalpía de la reacción es -67,578 kcal/mol.
La solución paso a paso sirve para comprender mejor todo el proceso. Queda claro que podríamos haber usado directamente los datos del enunciado en la fórmula:
ΔH = Hₚ - Hᵣ
ΔH = ΔHCO₂ - ΔHCO
ΔH = -93,973 kcal/mol - (-26,395 kcal/mol)
ΔH = -93,973 kcal/mol + 26,395 kcal/mol
ΔH = -67,578 kcal/mol
Se obtiene el mismo resultado.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP04
- | Siguiente ›
Ejemplo, cómo calcular el calor de formación de una reacción por etapas