Problema nº 8 de velocidad de reacción, comparación de velocidades de reacción - TP04
Enunciado del ejercicio nº 8
¿Cuál de las siguientes reacciones esperaría que fuera más rápida?
a) H₂ + Cl₂⟶ 2·HCl
b) H₂ + Br₂⟶ 2·HBr
Solución
La velocidad de reacción es directamente proporcional a la concentración de los reactantes. En este caso las concentraciones de los reactantes es la misma:
Vₐ = k·[H₂]·[Cl₂]
Vb = k·[H₂]·[Br₂]
Desde el punto de vista energético, ambas reacciones son espontáneas (energía de activación baja) y exotérmicas, son reacciones de formación completas.
Respecto a la energía de activación sabemos que:
- Si la energía de activación es alta, las reacciones son lentas.
- Si la energía de activación es baja, las reacciones son rápidas.
Haciendo los cálculos de las reacciones:
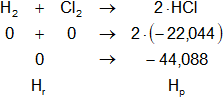
Planteamos la ecuación:
ΔHₐ = Hₚ - Hᵣ
Reemplazamos por los datos y calculamos:
ΔHₐ = -44,088 kcal/mol - 0 kcal/mol
ΔHₐ = -44,088 kcal/mol
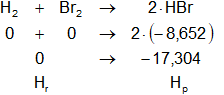
Planteamos la ecuación:
ΔHb = Hₚ - Hᵣ
Reemplazamos por los datos y calculamos:
ΔHb = -17,304 kcal/mol - 0 kcal/mol
ΔHb = -17,304 kcal/mol
ΔHₐ > ΔHb
Las reacciones quedan:
a) H₂ + Cl₂ ⟶ 2·HCl + 44,088 kcal
b) H₂ + Br₂ ⟶ 2·HBr + 17,304 kcal
La reacción (a) libera más calor que la reacción (b) por lo que se entiende que la reacción (a) requiere más energía de activación que la reacción (b), por lo tanto, se espera que la reacción (b) sea más rápida.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP04
- | Siguiente ›
Ejemplo, comparación de velocidades de reacción