Problema nº 1 de entalpía de reacción y calor latente, calor necesario para el cambio de estado del agua - TP08
Enunciado del ejercicio nº 1
La ecuación termoquímica para la combustión del gas etileno es:
C₂H₄(g) + 3·O₂(g) ⟶ 2·CO₂(g) + 2·H₂O(g) (ΔH = -338,86 kcal)
Admitiendo un rendimiento de 70 %, ¿cuántos kilogramos de agua a 20 °C pueden convertirse en vapor a 100 °C quemando 1.000 litros de etileno medidos en CNPT?
Desarrollo
Datos:
HC₂H₄ = 12,4851804 kcal/mol
HO₂ = 0 kcal/mol
HCO₂ = -93,972576 kcal/mol
HH₂O(l) = -69,213792 kcal/mol
η = 0,7
cₑ = 1 kcal/kg·°C (agua)
Lᵥ = 540,882 kcal/kg (agua)
Solución
La combustión completa de compuestos orgánicos producen la formación de agua y dióxido de carbono.
Expresamos la ecuación equilibrada de la reacción:
C₂H₄ + 3·O₂ ⟶ 2·CO₂ + 2·H₂O
Verificamos:
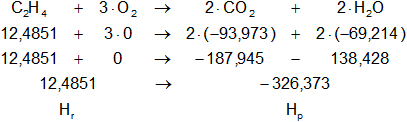
Planteamos la ecuación:
ΔH = Hₚ - Hᵣ
Reemplazamos por los datos y calculamos:
ΔH = -326,372736 kcal/mol - 12,4851804 kcal/mol
ΔH = -338,8579164 kcal/mol
22,4 litros de C₂H₄(g) equivale a 1 mol, entonces 1 mol de C₂H₄ desprende 338,8579164 kcal.
Calculamos el número de moles en 1.000 l de C₂H₄(g):
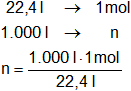
n = 44,64285714 moles de C₂H₄(g).
Calculamos el calor liberado por 1.000 l de C₂H₄(g):
Q = 44,64285714 moles·338,8579164 kcal/mol
Q = 15.127,58555 kcal
Calculamos el calor efectivo:
Qₑ = η·Q
Qₑ = 0,7·15.127,58555 kcal
Qₑ = 10.589,30989 kcal
Calculamos el calor sensible requerido para elevar la temperatura del agua de 20 °C a 100 °C:
Q₁ = m·Cₑ·(tf - tᵢ)
Q₁ = 1 kg·1 kcal/kg·°C·(100 °C - 20 °C)
Q₁ = 1 kcal/°C·80 °C
Q₁ = 80 kcal
Calculamos el calor latente requerido para elevar la temperatura de 100 °C de agua a 100 °C de vapor:
Q₂ = m·Lᵥ
Q₂ = 1 kg·540,882 kcal/kg
Q₂ = 540,882 kcal
Sumamos los calores requeridos:
QT = Q₁ + Q₂
QT = 80 kcal + 540,882 kcal
QT = 620,882 kcal
Calculamos la masa de agua que alcanzará 100 °C de vapor:
![]()
m = 17,05526958 kg
Respuesta: la masa de agua líquida a 20 °C que alcanzará los 100 °C en estado de vapor será 17,055 kg.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP08
- | Siguiente ›
Ejemplo, cómo calcular el calor necesario para el cambio de estado del agua