Problema nº 3 de entalpía de descomposición, calor de descomposición de un compuesto - TP08
Enunciado del ejercicio nº 3
Calcular la entalpía de descomposición del CaCO₃ en CaO y CO₂.
Desarrollo
Datos:
HCaCO₃ = -288,232 kcal/mol
HCaO = -152,0000208 kcal/mol
HCO₂ = -93,972576 kcal/mol
Solución
Expresamos la ecuación equilibrada de la reacción:
CaCO₃ ⟶ CaO + CO₂
Dada la reacción equilibrada, buscamos en la tabla de entalpías de formación la entalpía de cada sustancia:
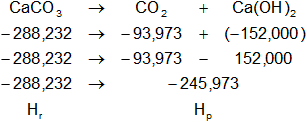
Planteamos la ecuación:
ΔH = Hₚ - Hᵣ
Reemplazamos por los datos y calculamos:
ΔH = -245,9725968 kcal/mol - (-288,232 kcal/mol)
ΔH = -245,9725968 kcal/mol + 288,232 kcal/mol
ΔH = 42,2594032 kcal/mol
Respuesta: la entalpía de descomposición es 42,26 kcal/mol.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP08
- | Siguiente ›
Ejemplo, cómo calcular el calor de descomposición de un compuesto