Problema nº 4 de entalpía de formación, calor de formación de un compuesto - TP08
Enunciado del ejercicio nº 4
El calor desarrollado en la combustión del acetileno a 25 °C es de 311,49 kcal/mol. Hallar la entalpía de formación del acetileno.
Desarrollo
Datos:
ΔH = 311,49 kcal/mol
Solución
La combustión completa de compuestos orgánicos producen la formación de agua y dióxido de carbono.
Expresamos la ecuación equilibrada de la reacción:
2·C₂H₂(g) + 5·O₂(g) ⟶ 4·CO₂(g) + 2·H₂O(l)
Para los cálculos usamos:
C₂H₂(g) + (5/2)·O₂(g) ⟶ 2·CO₂(g) + H₂O(l)
Dada la reacción equilibrada, buscamos en la tabla de entalpías de formación la entalpía de cada sustancia:
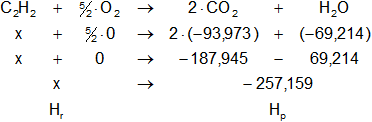
Planteamos la ecuación:
ΔH = Hₚ - Hᵣ
Reemplazamos por los datos y calculamos:
-311,485944 kcal/mol = -257,158944 kcal/mol - x
Despejamos x:
x = -257,158944 kcal/mol + 311,485944 kcal/mol
x = 54,327 kcal/mol
Respuesta: la entalpía de formación es 54,3 kcal/mol.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP08
- | Siguiente ›
Ejemplo, cómo calcular el calor de formación de un compuesto