Problema nº 6 de entalpía de reacción, calor de reacción - TP08
Enunciado del ejercicio nº 6
¿Cuál será la cantidad de calor desarrollada para obtener 22,4 litros (1 mol), en CNPT, de H₂S a partir de FeS y HCl diluido?
Desarrollo
Datos:
HFeS = -22,700328 kcal/mol
HH⁻ = 0 kcal/mol
HFe²⁺ = -21,0 kcal/mol
HH₂S(l) = -4,930026 kcal/mol
Solución
Expresamos la ecuación equilibrada de la reacción:
FeS + 2·H⁻ ⟶ Fe²⁺ + H₂S
El HCl y el FeCl₂ son electrolitos fuertes, solo se escriben los iones que intervienen.
Dada la reacción equilibrada, buscamos en la tabla de entalpías de formación la entalpía de cada sustancia:
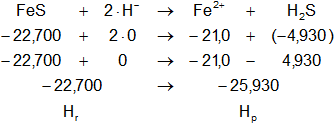
Planteamos la ecuación:
ΔH = Hₚ - Hᵣ
Reemplazamos por los datos y calculamos:
ΔH = -25,930026 kcal/mol - (-22,700328) kcal/mol
ΔH = -25,930026 kcal/mol + 22,700328 kcal/mol
ΔH = -3,229698 kcal/mol
Respuesta: 22,4 litros de H₂S(g) equivale a 1 mol, entonces 1 mol de H₂S requiere 3,23 kcal.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP08
- | Siguiente ›
Ejemplo, cómo calcular el calor de reacción