Problema nº 10 de entalpía de reacción, calor de reacción - TP08
Enunciado del ejercicio nº 10
Determinar el calor desarrollado en el apagado de un kilogramo de cal viva según la reacción:
CaO(s) + H₂O(l) ⟶ Ca(OH)₂(s)
Desarrollo
Datos:
HCaO = -152,0000208 kcal/mol
HH₂O = -69,213792 kcal/mol
HCaOH = -235,478292 kcal/mol
Solución
Expresamos la ecuación equilibrada de la reacción:
CaO + H₂O ⟶ Ca(OH)₂
Dada la reacción equilibrada, buscamos en la tabla de entalpías de formación la entalpía de cada sustancia:
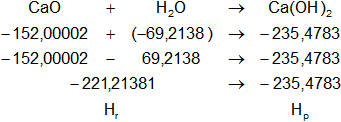
Planteamos la ecuación:
ΔH = Hₚ - Hᵣ
Reemplazamos por los datos y calculamos:
ΔH = -235,478292 kcal/mol - (-221,2138128 kcal/mol)
ΔH = -235,478292 kcal/mol - 221,2138128 kcal/mol
ΔH = -14,2644792 kcal/mol
Calculamos el mol del óxido de calcio:
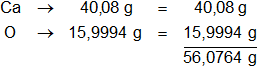
Calculamos el número de moles del óxido de calcio en 1 kg:
1 kg = 1.000 g
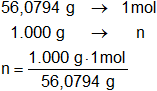
n = 17,83185983 moles
Calculamos el calor necesario para 1 kg de óxido de calcio:
Q = 17,83185983 moles·(-14,2644792) kcal/mol
Q = -254,3621936 kcal
Respuesta: la cantidad de calor necesaria para apagar 1 kg de óxido de calcio es -254,36 kcal.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP08
- | Siguiente ›
Ejemplo, cómo calcular el calor de reacción