Problema nº 7 de entalpía de disolución - TP09
Enunciado del ejercicio nº 7
La cantidad de calor desarrollada en la disolución del CuSO₄ es de 17,77 kcal/peso fórmula-gramo. ¿Cuál será el valor de ΔHf para el SO₄²⁻?
Desarrollo
Datos:
ΔH = -17,77 kcal/mol (fórmula-gramo ≡ mol)
Solución
Planteamos la ecuación balanceada:
CuSO₄ + H₂O ⟶ Cu²⁺ + SO₄²⁻ + H⁺ + OH⁻
A continuación, planteamos la ecuación iónica neta:
CuSO₄ ⟶ Cu²⁺ + SO₄²⁻
Dada la reacción equilibrada, buscamos en la tabla de entalpías de formación la entalpía de cada sustancia:
H°f-CuSO₄ = -184,000 kcal/mol
H°f-Cu = 15,376 kcal/mol
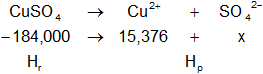
El intercambio de calor de la reacción es:
ΔH = Hₚ - Hᵣ
Reemplazamos por los valores:
-17,77 kcal/mol = 15,376 kcal/mol + x - (-184,000 kcal/mol)
-17,77 kcal/mol = 15,376 kcal/mol + x + 184,000 kcal/mol
Despejamos x:
x = -17,77 kcal/mol - 15,376 kcal/mol - 184,000 kcal/mol
x = Hf-SO₄ = -217,146 kcal/mol
Respuesta: la entalpía de disolución es -217,146 kcal/mol.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP09
- | Siguiente ›
Ejemplo, cómo calcular la entalpía de disolución