Problema nº 1 de entalpía de formación, calor de formación de un compuesto - TP09
Enunciado del ejercicio nº 1
El calor desprendido en la combustión completa de un mol de gas metano (CH₄) en CO₂(g) y H₂O(g) es de 214,5 kcal. Hallar la entalpía de formación de un mol de CH₄(g).
Desarrollo
Datos:
ΔH = -214,5 kcal
Solución
Expresamos la ecuación equilibrada de la reacción:
CH₄(g) + 2·O₂(g) ⟶ CO₂(g) + 2·H₂O(l)
Dada la reacción equilibrada, buscamos en la tabla de entalpías de formación la entalpía de cada sustancia:
HO₂ = 0 kcal/mol
HCO₂ = -93,973 kcal/mol
HH₂O = -69,214 kcal/mol
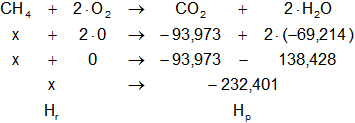
Planteamos la ecuación:
ΔH = Hₚ - Hᵣ
Reemplazamos por los datos y calculamos:
-214,5 = -232,400584 - x
Despejamos x:
x = -232,400584 + 214,5
x = -17,8799112
Respuesta: la entalpía de formación de un mol de CH₄(g) es -17,9 kcal/mol.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP09
- | Siguiente ›
Ejemplo, cómo calcular el calor de formación de un compuesto