Problema nº 2 de entalpía de formación, calor de formación de un compuesto - TP09
Enunciado del ejercicio nº 2
El calor desarrollado en la combustión de 1 gramo de almidón (C₆H₁₀O₅) en CO₂(g) y H₂O(g) es de 4,18 Kcal/g. Calcular la entalpía de formación de 1 g de almidón.
Desarrollo
Datos:
ΔH = -4,18 kcal
Solución
Expresamos la ecuación equilibrada de la reacción:
C₆H₁₀O₅(s) + 6·O₂(g) ⟶ 6·CO₂(g) + 5·H₂O(l)
Calculamos el mol del almidón:
C₆H₁₀O₅: 6·12,01115 g + 10·1,00797 g + 5·15,9994 g = 162,1436 g
Convertimos kcal/g a kcal/mol para un mol de almidón:
ΔH = (-4,18 kcal/g)·(162,1436 g/mol)
ΔH = -677,760248 kcal/mol
Dada la reacción equilibrada, buscamos en la tabla de entalpías de formación la entalpía de cada sustancia:
HO₂ = 0 kcal/mol
HCO₂ = -93,973 kcal/mol
HH₂O = -69,214 kcal/mol
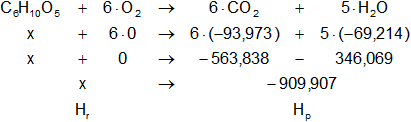
Planteamos la ecuación:
ΔH = Hₚ - Hᵣ
Reemplazamos por los datos y calculamos:
-677,760248 kcal/mol = -909,90696 kcal/mol - x
Despejamos x:
x = -909,90696 kcal/mol + 677,760248 kcal/mol
x = -232,146712 kcal/mol
Pide el resultado en gramos, hacemos la conversión:
x = (-232,146712 kcal/mol)÷(162,1436 g/mol)
x = -1,431735277 kcal/g
Respuesta: la entalpía de formación de un gramo de almidón es -1,432 kcal/g.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP09
- | Siguiente ›
Ejemplo, cómo calcular el calor de formación de un compuesto