Problema nº 3 de entalpía de reacción - TP09
Enunciado del ejercicio nº 3
El calor desprendido en la combustión de 1 mol de etano (C₂H₆) en CO₂(g) y H₂O(g) es de 372,9 kcal y el del eteno (C₂H₄) es de 337,3 kcal. Calcular ΔH en la siguiente reacción:
C₂H₄(g) + H₂(g) ⟶ C₂H₆(g)
Desarrollo
Datos:
ΔHC₂H₆ = -372,9 kcal
ΔHC₂H₄ = -337,3 kcal
Solución
Primero calculamos el calor de formación del etano.
Expresamos la ecuación balanceada de la combustión de etano:
C₂H₆(g) + 3,5·O₂(g) ⟶ 2·CO₂(g) + 3·H₂O(l)
Dada la reacción equilibrada, buscamos en la tabla de entalpías de formación la entalpía de cada sustancia:
HO₂ = 0 kcal/mol
HCO₂ = -93,973 kcal/mol
HH₂O = -69,214 kcal/mol
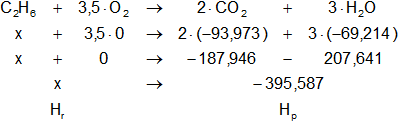
Planteamos la ecuación:
ΔH = Hₚ - Hᵣ
Reemplazamos por los datos y calculamos:
-372,9 = -395,587376 - x
Despejamos x:
x = -395,587376 + 372,9
x = Hf-C₂H₆ = -4,8074648 kcal/mol
Luego, calculamos el calor de formación del eteno.
Expresamos la ecuación balanceada de la combustión de eteno:
C₂H₄(g) + 3·O₂(g) ⟶ 2·CO₂(g) + 2·H₂O(l)
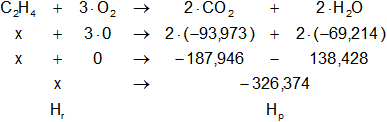
Planteamos la ecuación:
ΔH = Hₚ - Hᵣ
Reemplazamos por los datos y calculamos:
-337,3 = -326,373584 - x
Despejamos x:
x = -326,373584 + 337,3
x = Hf-C₂H₄ = 28,8063272 Kcal/mol
Finalmente, con los valores obtenidos anteriormente, calculamos el calor de la reacción dada.
Expresamos la ecuación balanceada de la reacción:
C₂H₄(g) + H₂(g) ⟶ C₂H₆(g)
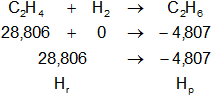
Planteamos la ecuación:
ΔH = Hₚ - Hᵣ
Reemplazamos por los datos y calculamos:
ΔH = -4,8074648 - 28,8063272
ΔH = -33,613792 kcal
Respuesta: la entalpía de la reacción es -33,6 kcal.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP09
- | Siguiente ›
Ejemplo, cómo calcular la entalpía de una reacción