Problema nº 4 de entalpía de neutralización - TP09
Enunciado del ejercicio nº 4
Calcular la entalpía de neutralización de un ácido fuerte por una base fuerte en agua.
Solución
Según el enunciado, podemos plantear la siguiente ecuación normal de neutralización:
H₊(ac) + OH⁻(ac) ⟶ H₂O(l)
Dada la reacción equilibrada, buscamos en la tabla de entalpías de formación la entalpía de cada sustancia:
Hf-H = 0 kcal/mol
Hf-OH = -54,960 kcal/mol
Hf-H2O = -69,213792 kcal/mol
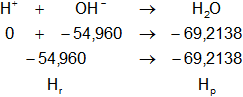
Planteamos la ecuación:
ΔH = Hₚ - Hᵣ
Reemplazamos por los datos y calculamos:
ΔH = -69,213792 kcal/mol - (-54,960 kcal/mol)
ΔH = -69,213792 kcal/mol + 54,960 kcal/mol
ΔH = -14,253792 kcal/mol
Respuesta: la entalpía de neutralización de un ácido fuerte por una base fuerte en agua es -14,254 kcal/mol.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP09
- | Siguiente ›
Ejemplo, cómo calcular la entalpía de neutralización