Problema nº 5 de entalpía de neutralización - TP09
Enunciado del ejercicio nº 5
Se procede a la neutralización del HCN (ácido débil) con NaOH. ¿Cuántas kcal se absorben en la ionización de un mol de HCN en agua?
Desarrollo
Datos:
ΔH = -2,5 kcal/mol
Solución
Planteamos la ecuación balanceada:
HCN + NaOH ⟶ NaCN + H₂O
A continuación, planteamos la ecuación iónica neta:
HCN(ac) + OH⁻(ac) ⟶ CN⁻(ac) + H₂O(l)
Dada la reacción equilibrada, buscamos en la tabla de entalpías de formación la entalpía de cada sustancia:
H°f-HCN = 25,074 kcal/mol
H°f-OH = -54,960 kcal/mol
H°f-CN = 36,059 kcal/mol
H°f-H2O = -69,214 kcal/mol
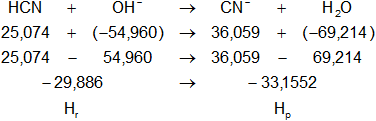
El intercambio de calor de la reacción es:
ΔH = Hₚ - Hᵣ
Reemplazamos por los valores:
ΔH = -33,1552 kcal/mol - (-29,886 kcal/mol)
ΔH = -33,1552 kcal/mol + 29,886 kcal/mol
ΔH = -3,2692 kcal/mol
Respuesta: la entalpía de neutralización es -3,27 kcal/mol.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP09
- | Siguiente ›
Ejemplo, cómo calcular la entalpía de neutralización