Problema nº 1 de calor sensible y calor latente de fusión y de vaporización, temperatura final en una mezcla - TP10
Enunciado del ejercicio nº 1
Calcular la temperatura resultante cuando 150 g de hielo a 0 °C se mezclan con 300 g de agua a 50 °C.
Desarrollo
Datos:
m₁ = 150 g = 0,150 kg
m₂ = 300 g = 0,300 kg
tᵢ₁ = 0 °C
tᵢ₂ = 50 °C
cLF hielo = 79,7 kcal/kg (*)
cₑ = 1,0 kcal/kg·°C (*)
(*) Datos de tabla: Calor sensible y calor latente de fusión y de vaporización.
Fórmulas:
Q = m·cₑ·(tf - tᵢ) (1)
QL = m·cLF
∑Q = 0
Solución
A mezclar ambas masas, el hielo se funde (cambia de estado) manteniendo su temperatura constante en 0 °C.
Calculamos el calor requerido:
QL = m₁·cLF
QL = 0,150 kg·79,7 kcal/kg
QL = 11,955 kcal
Cuando se mezclan dos masas a distinta temperatura el resultado final es el equilibrio térmico entre ambas, donde una de ellas cederá calor y la otra absorberá el calor cedido por la primera. La temperatura final será la misma para ambas masas.
tf1 = tf2 = tf
Por lo tanto, empleamos la ecuación (1) para ambos casos:
Q₁ = m₁·cₑ·(tf - tᵢ₁)
Q₂ = m₂·cₑ·(tf - tᵢ₂)
∑Q = Q₁ + Q₂ + QL = 0 (Condición de equilibrio térmico)
Q₁ + Q₂ + QL = 0
m₁·cₑ·(tf - tᵢ₁) + m₂·cₑ·(tf - tᵢ₂) + 11,955 kcal = 0
Aplicamos la propiedad distributiva:
m₁·cₑ·tf - m₁·cₑ·tᵢ₁ + m₂·cₑ·tf - m₂·cₑ·tᵢ₂ = -11,955 kcal
m₁·cₑ·tf + m₂·cₑ·tf = m₁·cₑ·tᵢ₁ + m₂·cₑ·tᵢ₂ - 11,955 kcal
Sacamos factor común tf:
(m₁ + m₂)·cₑ·tf = m₁·cₑ·tᵢ₁ + m₂·cₑ·tᵢ₂ - 11,955 kcal
Despejamos tf:
![]()
Reemplazamos por los valores y resolvemos:
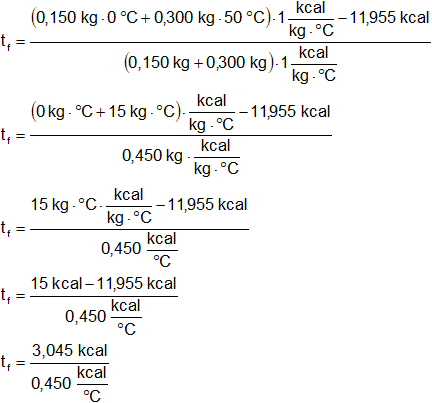
tf = 6,766666667 °C
Respuesta: la temperatura resultante es 6,8 °C.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP10
- | Siguiente ›
Ejemplo, cómo calcular la temperatura final en una mezcla