Problema nº 8 de calor sensible y calor latente de fusión y de vaporización, temperatura final en una mezcla - TP10
Enunciado del ejercicio nº 8
Se pasan 5 kg de vapor a 100 °C por 200 kg de agua a 5 °C. ¿Qué temperatura alcanzará la mezcla?
Desarrollo
Datos:
m₁ = 5 kg
m₂ = 220 kg
tᵢ₁ = 100 °C
tᵢ₂ = 5 °C
cLV = 539 kcal/kg (*)
cₑ = 1,0 kcal/kg·°C (*)
(*) Datos de tabla: Calor sensible y calor latente de fusión y de vaporización.
Fórmulas:
Q = m·cₑ·(tf - tᵢ) (1)
QL = m·cLV
∑Q = 0
Solución
A mezclar ambas masas, el vapor de agua se condensa (cambia de estado) manteniendo su temperatura constante en 100 °C.
Calculamos el calor requerido:
QL = m₁·cLV
QL = 5 kg·539 kcal/kg
QL = 2.695 kcal
Se debe tener en cuenta que QL < 0 porque entrega calor.
QL = -2.695 kcal
Cuando se mezclan dos masas a distinta temperatura el resultado final es el equilibrio térmico entre ambas, donde una de ellas cederá calor y la otra absorberá el calor cedido por la primera. La temperatura final será la misma para ambas masas.
tf1 = tf2 = tf
Por lo tanto, empleamos la ecuación (1) para ambos casos:
Q₁ = m₁·cₑ·(tf - tᵢ₁)
Q₂ = m₂·cₑ·(tf - tᵢ₂)
∑Q = Q₁ + Q₂ + QL = 0 (Condición de equilibrio térmico)
Q₁ + Q₂ + QL = 0
m₁·cₑ·(tf - tᵢ₁) + m₂·cₑ·(tf - tᵢ₂) - 2.695 kcal = 0
Aplicamos la propiedad distributiva:
m₁·cₑ·tf - m₁·cₑ·tᵢ₁ + m₂·cₑ·tf - m₂·cₑ·tᵢ₂ = 2.695 kcal
m₁·cₑ·tf + m₂·cₑ·tf = m₁·cₑ·tᵢ₁ + m₂·cₑ·tᵢ₂ + 2.695 kcal
Sacamos factor común tf:
(m₁ + m₂)·cₑ·tf = (m₁·tᵢ₁ + m₂·tᵢ₂)·cₑ + 2.695 kcal
Despejamos tf:
![]()
Reemplazamos por los valores y resolvemos:
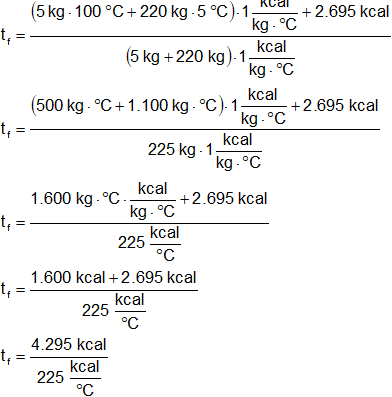
tf = 19,1 °C
Respuesta: la temperatura final de la mezcla es 19,1 °C.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP10
- | Siguiente ›
Ejemplo, cómo calcular la temperatura final en una mezcla