Problema nº 1 de calor sensible, temperatura final - TP11
Enunciado del ejercicio nº 1
a) ¿Cuántes calorías se necesitan para calentar 100 gramos de cobre desde 10 °C hasta 100 °C?
b) Se le entrega la misma cantidad de calor a 100 gramos de aluminio a 10 °C. ¿Cuál de los dos, cobre o aluminio, se calentará más?
Desarrollo
Datos:
m = 100 g
t₁ = 10 °C
t₂ = 100 °C
cₑ = 0,0923 kcal/kg·°C (calor específico del cobre)
cₑ = 0,215 kcal/kg·°C (calor específico del aluminio)
Fórmulas:
Q = m·cₑ·(t₂ - t₁)
Solución
a)
Aplicamos la ecuación de cantidad de calor para el cobre:
Q = m·cₑ·(t₂ - t₁)
Convertimos las unidades de masa:
![]()
m = 0,1 kg
Reemplazamos por los valores y calculamos:
Q = 0,0923 kcal/kg·°C·0,1 kg·(100 °C - 10 °C)
Q = 0,00923 kcal/°C·90 °C
Q = 0,8307 kcal
Resultado a), la cantidad de calor que necesita la masa de cobre es:
Q = 0,8307 kcal
b)
De la ecuación de cantidad de calor despejamos t₂ para el aluminio:
Q = m·cₑ·(t₂ - t₁)
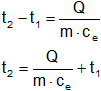
Reemplazamos por los valores y calculamos:

t₂ = 10 °C + 38,6372093 °C
t₂ = 48,6372093 °C
Resultado b), la temperatura final que alcanza la masa de aluminio con las mismas calorías es:
t₂ = 48,6 °C
La masa de cobre se calienta más con las mismas calorías.
Esto está implícito en el valor del calor específico de cada compuesto considerando la definición:
Calor específico del cobre < calor específico del aluminio.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP11
- | Siguiente ›
Ejemplo, cómo calcular la temperatura final