Problema nº 2 de calor sensible, cantidad de calor - TP11
Enunciado del ejercicio nº 2
La combustión de un gramo de antracita proporciona 7.300 cal. ¿Qué cantidad de dicho carbón hará falta para calentar 4 litros de agua desde 20 °C hasta el punto de ebullición? En CNPT
Desarrollo
Datos:
mₐ = 1 g
Qₐ = 7.300 cal
Vₐ = 4 l
t₁ = 20 °C
t₂ = 100 °C
cₑ = 1 kcal/kg·°C (calor específico del agua)
Fórmulas:
Q = m·cₑ·(t₂ - t₁)
Solución
Hallamos la cantidad de calor necesario para calentar 4 litros de agua.
Aplicamos la ecuación de cantidad de calor para el agua:
Q = m·cₑ·(t₂ - t₁)
Convertimos las unidades:
Vₐ = 4 l ≅ 4 kg = m
![]()
m = 0,001 kg
![]()
Qₐ = 7,3 kcal
Reemplazamos por los valores y calculamos:
Q = 1 kcal/kg·°C·4 kg·(100 °C - 20 °C)
Q = 4 kcal/°C·80 °C
Q = 320 kcal
La cantidad de calor necesario para calentar 4 litros de agua es Q = 320 kcal.
Luego, determinamos la cantidad de antracita necesaria para producir 320 kcal.
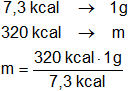
mₓ = 43,83561644 g
Respuesta, la masa de antracita necesaria es:
mₓ = 44 g
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP11
- | Siguiente ›
Ejemplo, cómo calcular la masa