Teoría de la corrosión (Parte I)
Corrosión
Se ha definido la corrosión de muchas formas:
Corrosión es el proceso por el cual los metales y las aleaciones son atacadas por soluciones acuosas, por el agua y por la atmósfera, formando compuestos indeseables.
La definición dada por el Comité Internacional de Corrosión es:
La corrosión es el deterioro de una sustancia, generalmente metálica, por la reacción con el medio que la rodea.
Por ejemplo: la formación de orín o herrumbren el hierro; la acción de los vapores ácidos sobre los metales; la alteración de las chapas de cobre, que se usaban para revestir los techos, por la acción de los humos provenientes de las fábricas, etc.
Teoría de la corrosión
Los metales están expuestos a la corrosión por ser elementos reductores (dadores de electrones).
Fe° ⟶ Fe²⁺ + 2·e (oxidación)
Zn° ⟶ Zn²⁺ + 2·e (oxidación)
Como luego veremos, en la corrosión de un metal es fundamental el fenómeno de oxidación de este.
Clasificación general de la corrosión
Corrosión química
Este tipo de oxidación se realiza por el contacto entre un metal y un ácido; metal con otro metal; metal con azufre, anhídrido sulfuroso, etc.
Ejemplos
1) Metal + ácido:
| Zn + 2·HCl | ⟶ | ZnCl₂ + H₂ | |
| Zn° - 2·e | ⟶ | Zn²⁺ | Oxidación |
| 2·Cl⁻ + 2·e | ⟶ | H₂° | Reducción |
El cinc se oxida por la acción de los iones hidrógeno.
Este tipo de corrosión se puede evitar fácilmente evitando el contacto de los metales con los ácidos.
2) Metal + azufre:
| Fe + S | ⟶ | FeS | |
| Fe° - 2·e | ⟶ | Fe²⁺ | Oxidación |
| S° + 2·e | ⟶ | S²⁻ | Reducción |
3) Metal + óxido ácido (anhídrido):
2·Cu + CO₂ + H₂O + O₂ ⟶ Cu(OH)₂ + CuCO₃
El cobre metálico expuesto a la atmósfera húmeda se oxida formando una capa color verde claro sobre su superficie. Algo común en las cúpulas que suelen tener los edificios públicos.
Corrosión electroquímica
Para explicar este tipo de corrosión lo haremos con el proceso de herrumbre. La herrumbre es el resultado de la formación de óxido férrico hidratado.
Fe₂O₃:n·H₂O
Las etapas de la formación de la herrumbre son las siguiente:
| 1) | Fe° ⟶ Fe²⁺ + 2·e |
| 2) | 2·H₂O ⟶ 2·OH⁻ + 2·H⁺ |
| 2·H⁺ + 2·e ⟶ 2·H | |
| 3) | 4·H + O₂ ⟶ 2·H₂O |
| 4) | 4·Fe²⁺ + O₂ + (4 + 2·n)·H₂O ⟶ 2·[Fe₂O₃:n·H₂O] + 8·H⁺ |
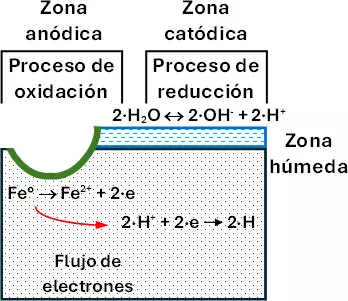
Etapa 1
Se produce en la zona anódica o ánodo.
Semirreacción de oxidación:
Fe° ⟶ Fe²⁺ + 2·e (E = 0,44 V)
El ánodo es la zona donde se produce la oxidación.
Los electrones liberados continúan el proceso. Para ello, los iones Fe²⁺ se disuelven en el agua, el hierro no se corroe en el aire seco.
Etapa 2
Los cationes H⁺ del agua captan los electrones que libera el hierro.
Semirreacción de reducción:
2·H⁺ + 2·e ⟶ 2·H (E = 0 V)
Este proceso de reducción ocurre en la zona catódica.
Se produce un flujo electrónico de la zona anódica a la zona catódica. Este flujo es contrario al sentido de la corriente.
Los átomos de hidrógeno no se desprenden como hidrógeno gaseoso, ya que durante el proceso no se observa desprendimiento de este gas.
Etapa 3
Los átomos de hidrógeno reaccionan con el oxígeno del aire, proceso que es catalizado por el mismo hierro:
| 4·H + O₂ | Catálisis ⟶ Fe | 2·H₂O |
Esto explica porque para que la corrosión se produzca, el agua debe contener oxígeno disuelto.
Etapa 4
Los cationes Fe²⁺ formados en la etapa 1, reaccionan con el oxígeno del aire y del agua, formando la herrumbre, liberando iones hidrógeno que intervienen en la etapa 2.
4·Fe²⁺ + O₂ + (4 + 2·n)·H₂O ⟶ 2·[Fe₂O₃:n·H₂O] + 8·H⁺
Este óxido hidratado o herrumbre no se adhiere a la zona anódica, impidiendo la protección del metal.
Bibliografía:
Héctor Fernández Serventi. "Química". Losada S. A., Buenos Aires.
Autor: Ricardo Santiago Netto. Argentina