Teoría de la corrosión (Parte IV)
Factores que retardan o impiden el proceso de la corrosión
Tratamientos de superficie
Protección con coberturas metálicas
Cementado
Este procedimiento consiste en calentar al metal que se desea proteger, con otro metal (protector) en polvo, a una temperatura inferior al punto de fusión del metal menos fusible.
Según el metal que se emplea para cubrir por cementación al hierro, el proceso toma nombres variados:
a) Cementado con cinc: shedarizado.
b) Cementado con cromo: cromizado.
c) Cementado con silicio: siliconado.
Protección por recubrimiento electrolítico
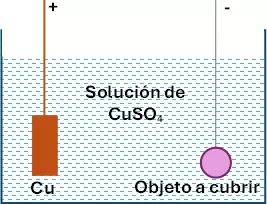
Por medio de este método se cubre al hierro con un baño de metal protector que se deposita por un proceso electrolítico.
El objeto que cubrir actúa como cátodo en una cuba electrolítica, este objeto debe estar bien pulido y limpio, libre de sustancias extrañas. La solución de la cuba es una sal del metal que se emplea como protector. El ánodo está constituido por el metal protector.
Es muy importante mantener una corriente constante en el tiempo; la concentración de la solución y la temperatura.
Los metales que se emplean como agentes protectores, son: cobre, cinc, estaño, níquel, oro y plata.
Enchapado
Se llama así al recubrimiento de metales no nobles con láminas de metales nobles.
Así se preparan lingotes de hierro protegidos con láminas de cobre que luego pueden laminarse o reducirse a alambres.
Los dos metales que se emplean en el enchapado deben tener coeficientes de maleabilidad muy semejantes.
Aspersión catódica
En una cámara de vacío, provista de un ánodo y un cátodo (este último construido por el metal de recubrimiento), se colocan las piezas metálicas.
Se produce una descarga de 1.000 a 2.000 V. El cátodo se volatiliza, depositándose su vapor metálico sobre los objetos que se desean proteger.
Protección por cubiertas inorgánicas
Vidriado
Se prepara el esmalte vidriado fundiendo una mezcla de cuarzo (SiO₂) y feldespato con fundente como criolita (3·NaF; F₃Al) y el carbonato de sodio.
La superficie debe estar limpia y libre de grasitud. El objeto a vidriar se sumerge en dicha mezcla o se aplica por medio de soplete. Luego se colocan las piezas cubiertas en un horno que las deja esmaltadas.
Se emplea el esmaltado para cubrir artefactos sanitarios, vagones tanques utilizados para transportar productos químicos o alimentos, etc.
Fosfatizado
Por este método se logra la protección del hierro con una solución de fosfato de manganeso aplicada en caliente.
La protección que se logra no es total, pues la superficie metálica que se desea proteger queda porosa.
Se termina el proceso con pinturas al aceite o barnices.
Sulfinizado
Por este método se protege al hierro y al acero sumergiéndolos en un baño salino constituido por sulfito de sodio, cloruro y cianuro de sodio, a una temperatura de superior a 500 °C.
Se forma un sulfocianuro de sodio que cubre al metal, penetrando en el mismo, formando una capa de menos de 0,5 mm de espesor.
Las piezas sulfinizadas adquieren una gran resistencia al desgaste. Por este motivo se emplea el Sulfinizado en piezas para motores.
Protección por coberturas orgánicas
Este tipo de protección está constituido por las pinturas, barnices y lacas. Las pinturas pueden ser al aceite, a la caseína o al látex.
Sin considerarlas orgánicas, se debe mencionar las pinturas anticorrosivas como las que contienen minio (ortoplumbato de plomo Pb·Pb₂O₄) o bermellón (cromato básico de plomo Pb(OH)₂·PbCrO₄) y cuya acción de los iones CrO₄ y PbO₄ de efecto oxidante.
Los barnices forman películas más duras que las pinturas, pero son menos resistentes a la acción de la luz. El efecto de los barnices se mejora con el agregado de aceites de siliconas.
Las lacas están constituidas por nitrocelulosa con resinas envolventes apropiadas (lacas a la piroxilina).
Protección catódica
El recubrimiento del hierro con cinc (galvanizado), es un procedimiento de protección catódica, pues el potencial de oxidación del cinc es superior al del hierro y los electrones pasan a éste.
La protección catódica de tuberías y cascos de buques se logra formando pares Fe-Zn o Fe-Mg.
En el caso de tuberías, se clavan barras de cinc o magnesio en el suelo y se las pone en contacto con la tubería. Los electrones pasan del cinc al hierro de las tuberías, el cual queda protegido.
En los cascos de los buques, se adhieren bloques de magnesio al casco. Estos bloques, debido a su mayor potencial de oxidación, se corroen, actuando como ánodo, protegiendo al acero del casco. Dicha protección dura mientras no se consuma el magnesio, llegado ese caso, los bloques de magnesio se reemplazan.
Hierro y acero
Anteriormente se hizo la aclaración que el hierro puro no se usa en la industria o en la construcción o en piezas de cualquier uso, lo que se usa es el acero.
El acero es, principalmente, una combinación de hierro y carbono en distintos porcentajes, pero sin superar el 1,7 % de carbono en hierro. También puede contener otros metales para aleaciones especiales como en el caso del acero inoxidable o el acero criogénico. O porcentajes bajos de carbono que es el caso del acero usado en la construcción de buques, es un acero más "flexible" y apto para soldaduras intensas.
Todas estas variedades de acero forman pares metal-metal con distintos potenciales de oxidación. A esto hay que sumarle las impurezas y las variaciones en las condiciones de fabricación. Para que quede claro, distintas chapas de acero de un mismo lote de producción pueden tener diferentes composiciones, aunque mínimas producen diferentes potenciales.
En el caso de las chapas de acero soldadas en los cascos de los buques o en la estructura de tanques contenedores, la soldadura se compone de un material algo distinto al de la chapa, generando un nuevo par metal-metal. Para ir al extremo, el eje de la hélice de un buque tiene una composición (potencial de oxidación) muy distinto al de las chapas que lo rodean, tenemos un nuevo par metal-metal.
Un alambre de acero común olvidado sobre una estructura de acero inoxidable logrará contaminar al acero inoxidable en el lugar donde hizo contacto con el alambre.
Las puertas de chapa unidas a un marco de chapa por medio de una bisagra de acero forman pares metal-metal. La diferencia de potencial de oxidación puede ser mínima, pero existe.
Por estas razones, dadas como ejemplo, y muchas más, hacen del estudio de la corrosión del acero y su protección, un campo muy amplio de estudio.
Bibliografía:
Héctor Fernández Serventi. "Química". Losada S. A., Buenos Aires.
Autor: Ricardo Santiago Netto. Argentina