Pilas
Pila eléctrica
Todas las pilas consisten en un electrolito (que puede ser líquido, sólido o en pasta), un electrodo positivo y un electrodo negativo. Al conectar los electrodos al aparato que hay que alimentar, llamado carga, se produce una corriente eléctrica.
Las pilas en las que el producto químico no puede volver a su forma original una vez que la energía ha sido consumida, se llaman pilas primarias o voltaicas. Las pilas en las que el producto químico puede ser reconstituido se llaman pilas secundarias o acumuladores.
El potencial normal de una pila es el voltaje que se obtiene de ella, cuando la concentración de los iones en cada semipila es 1 M o sea, cuando cada uno de los metales se halla sumergido en una solución 1M de una de sus sales y a 25 °C.
La fuerza electromotriz de la pila, se calcula restando del potencial del ánodo el valor del potencial del cátodo.
E = ΔE⁻ - ΔE⁺
Pilas primarias
La pila primaria más común es la pila seca. La pila seca que se utiliza hoy es muy similar al invento original. El electrolito es una pasta consistente en una mezcla de cloruro de amonio y cloruro de cinc. El electrodo negativo es de cinc, igual que la parte exterior de la pila, y el electrodo positivo es una varilla de carbono rodeada por una mezcla de carbono y dióxido de manganeso. Esta pila produce una fuerza electromotriz de unos 1,5 V.
Anodo:
Zn° ⟶ Zn²⁺ + 2·e⁻
Cátodo:
2·MnO₂ + 2·NH₄⁺ + 2·e ⟶ Mn₂O₃ + 2·NH₃ + H₂O
Reacción Global:
Zn + 2·MnO₂ + 2·NH₄Cl + ZnCl₂ ⟶ 2·ZnCl₂ + Mn₂O₃ + 2·NH₃ + H₂O
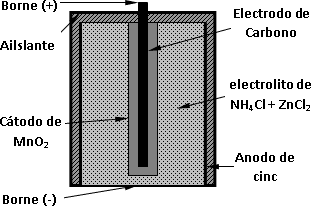
Esquema de una pila y sus componentes
Otra pila primaria muy utilizada es la pila de cinc-óxido de mercurio, conocida normalmente como batería de mercurio. Puede tener forma de disco pequeño y se utiliza en audífonos, células fotoeléctricas, relojes de pulsera eléctricos, calculadoras, etc. El electrodo negativo es de cinc, el electrodo positivo de óxido de mercurio y el electrolito es una disolución de hidróxido de potasio. La batería de mercurio produce unos 1,34 V.
Anodo:
Zn° + 2·OH⁻ ⟶ ZnO + H₂O + 2·e⁻
Cátodo:
HgO + H₂O + 2·e ⟶ Hg + 2·OH⁻
Reacción Global:
Zn + HgO + KOH + H₂O ⟶ ZnO + Hg + KOH + H₂O
Pila de combustible
Mecanismo electroquímico en el cual la energía de una reacción química se convierte directamente en electricidad. Una pila de combustible no se acaba ni necesita ser recargada; funciona mientras el combustible y el oxidante le sean suministrados desde fuera de la pila.
Una pila de combustible consiste en un ánodo en el que se inyecta el combustible (comúnmente hidrógeno, amoníaco o hidracina) y un cátodo en el que se introduce un oxidante (normalmente aire u oxígeno). Los dos electrodos de una pila de combustible están separados por un electrolito iónico conductor. En el caso de una pila de combustible de hidrógeno-oxígeno con un electrolito de hidróxido de metal alcalino, la reacción es:
Anodo:
2·H² + 4·OH⁻ ⟶ 4·H₂O + 4·e⁻
Cátodo:
O₂ + 2·H₂O + 4·e ⟶ 4·OH⁻
Los electrones generados en el ánodo se mueven por un circuito externo que contiene la carga y pasan al cátodo. Los iones OH⁻ generados en el cátodo son conducidos por el electrolito al ánodo, donde se combinan con el hidrógeno y forman agua. El voltaje de la pila de combustible en este caso es de unos 1,2 V pero disminuye conforme aumenta la carga. El agua producida en el ánodo debe ser extraída continuamente para evitar que inunde la pila. Las pilas de combustible de hidrógeno-oxígeno que utilizan membranas de intercambio iónico o electrólitos de ácido fosfórico fueron utilizadas en los programas espaciales Gemini y Apolo respectivamente. Las de ácido fosfórico tienen un uso limitado en las instalaciones eléctricas generadoras de energía.
Pilas secundarias
Acumulador: o pila secundaria, puede recargarse revirtiendo la reacción química. Esta pila es una batería de plomo y ácido, y es la que más se utiliza en la actualidad. Esta batería que contiene de tres a seis pilas conectadas en serie, se usa en automóviles, camiones, aviones y otros vehículos. Su ventaja principal es que puede producir una corriente eléctrica suficiente para arrancar un motor; sin embargo, se agota rápidamente. El electrolito es una disolución diluida de ácido sulfúrico, el electrodo negativo es de plomo y el electrodo positivo de dióxido de plomo. En funcionamiento, el electrodo negativo de plomo se disocia en electrones libres e iones positivos de plomo. Los electrones se mueven por el circuito eléctrico externo y los iones positivos de plomo reaccionan con los iones sulfato del electrolito para formar sulfato de plomo. Cuando los electrones vuelven a entrar en la pila por el electrodo positivo de dióxido de plomo, se produce otra reacción química. El dióxido de plomo reacciona con los iones hidrógeno del electrolito y con los electrones formando agua e iones plomo; estos últimos se liberarán en el electrolito produciendo nuevamente sulfato de plomo.
Anodo:
Pb + SO₄⁼ ⟶ PbSO₄ + 2·e⁻
Cátodo:
PbO₂ + SO₄⁼ + 4·H⁺ ⟶ PbSO₄ + H₂O
Reacción Global:
Pb + PbO₂ + 2·H₂SO₄ ⟶ 2·PbSO₄ + 2·H₂O
En el acumulador se proporciona energía eléctrica desde una fuente exterior, que se almacena en forma de energía química. La reacción química de una pila secundaria es reversible, es decir, se produce en un sentido cuando se carga la pila, y en sentido opuesto cuando se descarga. Por ello, una pila secundaria puede descargarse una y otra vez.
Un acumulador de plomo y ácido se agota porque el ácido sulfúrico se transforma gradualmente en agua y en sulfato de plomo. Al recargar la pila, las reacciones químicas descritas anteriormente se revierten hasta que los productos químicos vuelven a su condición original. Produce unos 2 V por pila. Recientemente, se han desarrollado baterías de plomo para aplicaciones especiales con una vida útil de 50 a 70 años.
Pila Alcalina: O batería de níquel y hierro. El principio de funcionamiento es el mismo que en la pila de ácido y plomo, pero aquí el electrodo negativo es de hierro, el electrodo positivo de óxido de níquel y el electrolito es una disolución de hidróxido de potasio. La pila de níquel y hierro tiene la desventaja de desprender gas hidrógeno durante la carga. Esta batería se usa principalmente en la industria pesada. Tiene una vida útil de unos diez años y produce aproximadamente unos 1,15 V.
Otra pila alcalina similar, es la pila de níquel y cadmio o batería de cadmio, en la que el electrodo de hierro se sustituye por uno de cadmio. Produce también 1,35 V y su vida útil es de unos 25 años.
Anodo.
Cd + 2·OH⁻ ⇔ Cd(OH)₂ + 2·e⁻
Cátodo:
NiO(OH) + H₂O + e⁻ ⇔ Ni(OH)₂ + OH⁻
Reacción Global
Cd + NiO(OH) + H₂O ⇔ Ni(OH)₂ + Cd(OH)₂
Batería: Aparato que transforma la energía química en eléctrica, y consiste en dos o más pilas eléctricas conectadas en serie o en paralelo en mixto. Se han desarrollado diversos tipos de nuevas baterías para vehículos eléctricos. Se trata de versiones mejoradas de las baterías convencionales, pero aún tienen numerosos inconvenientes como su corta duración, alto costo, gran volumen o problemas medioambientales. Las baterías destinadas a vehículos eléctricos incorporan sulfuro de litio-hierro, cinc-cloro, hidruro de níquel y sulfuro de sodio. Las compañías suministradoras de electricidad están desarrollando este tipo de baterías para utilizarlas como "niveladores de carga", a fin de compensar las fluctuaciones esporádicas del sistema. Estas baterías ocupan poco espacio y apenas tienen efectos dañinos para el medioambiente.
Pilas solares
Las pilas solares producen electricidad por un proceso de conversión fotoeléctrica. La fuente de electricidad es una sustancia semiconductora fotosensible, como un cristal de silicio al que se le han añadido impurezas. Cuando la luz incide contra el cristal, los electrones se liberan de la superficie de éste y se dirigen a la superficie opuesta. Allí se recogen como corriente eléctrica. Las pilas solares tienen una vida muy larga y se utilizan sobre todo en los aviones como fuente de electricidad para el equipo de a bordo.
Autor: Ricardo Santiago Netto. Argentina
¿Qué es una pila electroquímica? ¿Qué es una pila galvánica? ¿Qué es y cómo funciona una pila?