Problema nº 5 de electrólisis. Leyes de Faraday, corriente para que un elemento se deposite en un electrodo - TP01
Enunciado del ejercicio nº 5
En un voltímetro con solución de sulfato cúprico se ha obtenido un depósito de 80 mg de cobre en 5 minuto. Calcular la intensidad de la corriente.
Desarrollo
Datos:
t = 5 minutos
m Cu = 80 mg
ζCu = 0,000329 g/C *
Fórmulas:
m = ζ·i·t
Solución
Convertimos las unidades:
t = 5 min = 5 min·60 s/min
t = 300 s
m Cu = 80 mg = 80 mg·(1 g/1.000 mg)
m Cu = 0,08 g
Aplicamos la primera ley de Faraday:
m = ζ·i·t
Despejamos i:
![]()
Reemplazamos por los datos y calculamos:
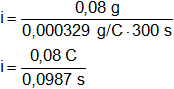
Recordemos que C/s = A.
i = 0,810536981 A
Respuesta: la corriente requerida es de 0,8 A.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo, cómo calcular la corriente necesaria para que un elemento se deposite en un electrodo