Problema nº 7 de electrólisis. Segunda ley de Faraday, masa depositada en un electrodo - TP01
Enunciado del ejercicio nº 7
Si en un proceso electrolítico se depositaron 10 mg de plata, ¿cuántos gramos de cobre bivalente se hubieran depositado?
Desarrollo
Datos:
mAg = 10 mg
Masa atómica Ag = 107,87 g (valencia 1)
Masa atómica Cu = 63,54 g (valencia 2)
Fórmulas:
![]()
Solución
Calculamos el equivalente químico de la plata:
EqAg⁺ = 107,87
Calculamos el equivalente químico del cobre:
EqCu²⁺ = 63,54/2
EqCu²⁺ = 31,75
Convertimos las unidades:
mAg = 10 mg = 10 mg·(1 g/1.000 mg)
mAg = 0,001 g
Aplicamos la segunda ley de Faraday:
![]()
Despejamos mCu²⁺:
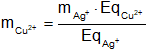
Reemplazamos por los datos y calculamos:
![]()
mCu²⁺ = 0,002945269 g
Respuesta: la masa depositada de cobre bivalente es 0,003 g
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo, cómo calcular la masa que se deposita en un electrodo