Problema nº 9 de electrólisis. Leyes de Faraday, corriente para que un elemento se deposite en un electrodo - TP01
Enunciado del ejercicio nº 9
¿Qué cantidad de corriente debe utilizarse para depositar, en 3 minutos 2 moles de cobre sobre un electrodo?
Desarrollo
Datos:
t = 3 minutos
Moles Cu = 2
ζCu²⁺ = 0,000329 g/C *
Fórmulas:
m = ζ·i·t
Solución
Calculamos el peso molecular del cobre:
Mol Cu = 63,54 g
m = 2·Mol Cu
m = 2·63,54 g
m = 127,08 g
Convertimos las unidades:
t = 3 min = 3·60 s
t = 180 s
Aplicamos la primera ley de Faraday:
m = ζ·i·t
Despejamos i:
![]()
Reemplazamos por los datos y calculamos:
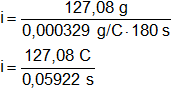
Recordemos que C/s = A.
i = 2.145,896657 A
Respuesta: la corriente requerida es de 2.146 A.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP01
- | Siguiente ›
Ejemplo, cómo calcular la corriente necesaria para que un elemento se deposite en un electrodo