Problema nº 8 de electrólisis. Ecuación de Nernst, celda voltaica, voltaje máximo - TP02
Enunciado del ejercicio nº 8
¿Cuál es el voltaje máximo esperado de una celda voltaica constituida por las hemiceldas Cu-Cu²⁺ y Ag-Ag⁺? Escriba las reacciones de electrodo y la total.
Desarrollo
Fórmulas:
Ecuación de Nernst
![]()
Solución
a) Reacciones de electrodo.
Reacción de reducción:
Ag⁺ + e ⟶ Ag°
Reacción de oxidación:
Cu° - 2·e ⟶ Cu²⁺
Reacción total:
2·Ag⁺ + Cu° ⟶ 2·Ag° + Cu²⁺
b) Cálculo del voltaje.
La concentración de los reactantes y de los productos no son datos, suponemos concentraciones iguales.
[Cu/Cu²⁺] = [Ag/Ag⁺]
El valor de E° será:
E° = 0,80 V - (-0,34 V) *
E° = 0,80 V + 0,34 V
E° = 1,14 V
* Datos de la tabla de potenciales de oxidación-reducción.
Se supone que la reacción ocurre a presión y temperatura normales.
Aplicamos la ecuación de Nernst:
![]()
n es desconocido.
Como [Cu/Cu²⁺] = [Ag/Ag⁺]
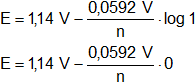
E = 1,14 V - 0
E = 1,14 V
Respuesta b): el voltaje máximo esperado es 1,14 V.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP02
- | Siguiente ›
Ejemplo, cómo calcular el voltaje máximo en una celda voltaica