Problema nº 4 de electrólisis. Fórmula-gramo dada la constante de equilibrio - TP03
Enunciado del ejercicio nº 4
Calcular cuantas fórmula-gramo oxhidrilo se hallan disociadas en 1 litro de solución 0,1 M de NH₄OH.
Desarrollo
El NH₄OH desprende un ion oxhidrilo o hidroxilo (valencia = 1), por lo tanto, 0,1 M = 0,1 N.
Datos:
V = 1 l
C = 0,1 M
kb = 1,8·10⁻⁵ (Constante de disociación del NH₄OH a 25 °C)
Solución
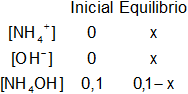
Aplicamos la constante de equilibrio para una base (kb):
![]()
Reemplazamos:
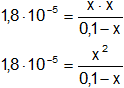
1,8·10⁻⁵·(0,1 - x) = x²
Igualamos a cero:
x² - 1,8·10⁻⁵·(0,1 - x) = 0
Aplicamos distributiva del producto con respecto a la resta:
x² - 1,8·10⁻⁶ + 1,8·10⁻⁵·x = 0
x² + 1,8·10⁻⁵·x - 1,8·10⁻⁶ = 0
Aplicamos la ecuación de Báscara o Bhaskara:
![]()
Siendo:
a = 1
b = 1,8·10⁻⁵
c = -1,8·10⁻⁶
Reemplazamos y resolvemos, obtendremos dos valores:
![]()
Resolvemos:
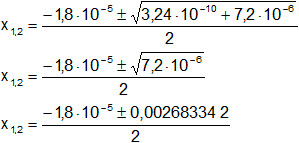
Calculamos los valores por separado según el signo del resultado de la raíz:
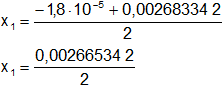
x₁ = 0,001332671 mol/l
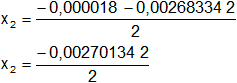
x₂ = -0,001350671 (descartamos por < 0)
La fórmula-gramo o peso fórmula-gramo es el peso molecular o mol de una sustancia, como vemos el resultado está expresado en moles por litro, o sea, fórmula-gramo por litro.
Respuesta: en 1 litro de solución 0,1 M de NH₄OH hay 1,33·10⁻³ fórmula-gramo oxhidrilo.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP03
- | Siguiente ›
Ejemplo, cómo calcular la fórmula-gramo dada la constante de equilibrio