Problema nº 7 de pH de un ácido de una solución - TP04
Enunciado del ejercicio nº 7
Un litro de solución de ácido sulfúrico contiene 0,049 gramos de ácido. ¿Cuál es el pH suponiendo disociación total?
Desarrollo
Solución normal de un ácido, de una base o de una sal es aquella que tiene un equivalente gramo del ácido, de la base o de la sal, disueltos en un litro de solución.
El mol es la suma de los pesos atómicos de todos los elementos que forman la molécula.
El equivalente gramo de un ácido o de una base es la masa de estos que resulta de dividir su mol por el número de iones H⁺ (protones) o de iones OH⁻ (oxhidrilos) que produce una molécula de ácido o de base al ionizarse.
Fórmulas:
![]()
Solución
Los pesos atómicos de los elementos presentes en el ácido sulfúrico son:
mH = 1,00797 g
mS = 32,064 g
mO = 15,9994 g
H₂SO₄
Multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
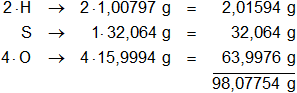
El ácido sulfúrico desprende 2 H⁺ disociado totalmente. Calculamos el equivalente gramo:
![]()
Reemplazamos por los datos y resolvemos:
![]()
Eg = 49,03877 g
Calculamos la normalidad (N) de la solución dada:
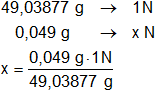
x = 0,000999209 N ≅ 0,001 N
La concentración de iones [H⁺] o de iones [OH⁻] de un ácido o de una base totalmente disociados coincide con la normalidad de la solución.
Aplicamos la fórmula de pH:
pH = -log [H⁺]
Reemplazamos por los datos y calculamos:
pH = -log 0,001
pH = -log 10⁻³
pH = -(-3)·log 10
pH = 3·1
pH = 3
Respuesta: el pH de la solución de ácido sulfúrico es 3.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP04
- | Siguiente ›
Ejemplo, cómo calcular el pH de una solución ácida