Problema nº 10 de ácidos y bases, concentración y pH de una solución - TP04
Enunciado del ejercicio nº 10
Se tiene una solución de ácido sulfúrico cuyo pH es 4. Calcular su concentración en gramos de ácido sulfúrico por litro de solución.
Desarrollo
Solución normal de un ácido, de una base o de una sal es aquella que tiene un equivalente gramo del ácido, de la base o de la sal, disueltos en un litro de solución.
El mol es la suma de los pesos atómicos de todos los elementos que forman la molécula.
El equivalente gramo de un ácido o de una base es la masa de estos que resulta de dividir su mol por el número de iones H⁺ (protones) o de iones OH⁻ (oxhidrilos) que produce una molécula de ácido o de base al ionizarse.
Fórmulas:
![]()
Solución
Expresamos la ecuación de disociación:
H₂SO₄ ⇌ 2·H⁺ + SO₄²⁻
Aplicamos la fórmula de pH:
pH = -log₁₀ [H⁺]
Según la definición de logaritmo:
logₐ b = c ⇔ b = aᶜ
Despejamos [H⁺]:
[H⁺] = 10⁻pH
Reemplazamos y hallamos la concentración de hidrógeno:
[H⁺] = 10⁻⁴ iones/l ≡ 10⁻⁴ N
Calculamos el mol de ácido sulfúrico y el equivalente gramo.
Los pesos atómicos de los elementos presentes en el ácido sulfúrico (H₂SO₄) son:
mH = 1,00797 g
mS = 32,064 g
mO = 15,9994 g
Multiplicamos por la cantidad de átomos presentes en la sustancia y sumamos:
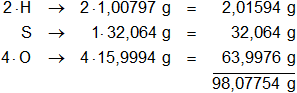
El ácido sulfúrico desprende 2 H⁺ disociado totalmente. Calculamos el equivalente gramo:
![]()
Reemplazamos por los datos y resolvemos:
![]()
Eg = 49,03877 g
Una solución 1 N de ácido sulfúrico contiene 49,07754 g de ácido.
Calculamos la masa de la solución dada:
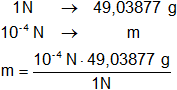
x = 0,004903877 g/l
Respuesta: la concentración de la de solución de ácido sulfúrico es 0,0049 g/l.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP04
- | Siguiente ›
Ejemplo, cómo calcular la concentración de una solución dado el pH