Problema nº 8 de electrólisis. Porcentaje de ionización y ka, constante de equilibrio - TP05
Enunciado del ejercicio nº 8
Una solución 1 M de HA se ioniza en agua 2 %. Calcular kₐ.
Desarrollo
El HA desprende un ion hidrógeno (valencia = 1), por lo tanto, 1 M = 1 N.
Solución
Expresamos la ecuación balanceada de disociación:
HA + H₂O ⟶ H₃O⁺ + A⁻
La constante de equilibrio para un ácido (kₐ) es:
![]()
Planteamos los moles iniciales y en el equilibrio:
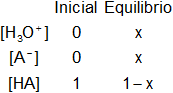
Planteamos el porcentaje de ionización:
Porcentaje de ionización = ![]()
Reemplazamos:
![]()
Despejamos x:
2·(1 - x) = x·100
Aplicamos distributiva del producto con respecto a la resta:
2 - 2·x = x·100
2 = x·100 + 2·x
102·x = 2
![]()
x = 0,019607843
Aplicamos la constante de equilibrio kₐ:
![]()
Reemplazamos por los datos y calculamos:
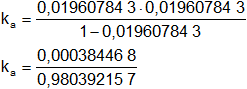
kₐ = 0,000392157
Respuesta: la constante de equilibrio kₐ de la solución 1 M de HA es 3,92·10⁻⁴.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP05
- | Siguiente ›
Ejemplo, cómo calcular la constante de equilibrio dado el porcentaje de ionización