Problema nº 5 de electrólisis. Primera ley de Faraday, tiempo para que la masa de un elemento se deposite en un electrodo - TP06
Enunciado del ejercicio nº 5
¿Cuánto tempo demandará depositar 100 g de aluminio de una celda electrolítica que contiene Al₂O₃ con una corriente de 125 A? Suponer que la única reacción en el cátodo es la formación de aluminio.
Desarrollo
Datos:
i = 125 A
m Al = 100 g
ζAl³⁺ = 0,000093 g/C (*)
(*) Dato de tabla
Fórmulas:
m = ζ·i·t
Solución
Para el cálculo del tiempo empleado aplicamos la primera ley de Faraday:
m = ζ·i·t
Despejamos t:
![]()
Reemplazamos por los datos y calculamos:
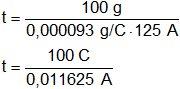
Recordemos que C/s = A.
t = 8.602,150538 s
Respuesta: el tiempo requerido es de 8.602 s (2 h 23 min 22 s).
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP06
- | Siguiente ›
Ejemplo, cómo calcular el tiempo que demora la masa de un elemento en depositarse en un electrodo