Problema nº 8 de electrólisis. Carga eléctrica necesaria para que un elemento se deposite en el electrodo - TP06
Enunciado del ejercicio nº 8
¿Cuántos culombios son necesarios en una celda para la producción electrolítica de 245 g de NaClO₄ a partir de NaClO₃? A causa de reacciones secundarias, el rendimiento del ánodo para la reacción deseada es del 60 %.
Desarrollo
Datos:
mNaClO₄ = 245 g
η = 0,60
F = 96.494 C
Fórmulas:
m = ζ·i·t
![]()
Solución
Planteamos la ecuación balanceada:
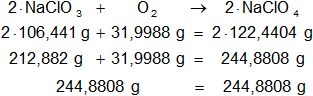
244,8808 g de NaClO₄ ≅ 245 g de NaClO₄ ⟶ 2 moles de NaClO₄
MolNaClO₄ = 122,4404 g
Planteamos la reacción en el ánodo:
ClO₃⁻ + H₂O ⟶ ClO₄⁻ + 2·H⁺ + 2·e
Número de oxidación o valencia = 2 (2 electrones)
Calculamos el equivalente químico del NaClO₄:
![]()
Reemplazamos por los datos y resolvemos:
![]()
Eq = 61,2202 g
Con el dato del equivalente químico calculamos la cantidad de Eq que se requieren:
![]()
Reemplazamos por los datos y calculamos:
![]()
n Eq = 4,00194707
El rendimiento es η = 0,60, por tanto, se necesitaran más Eq:
![]()
n Eq = 6,669911783
Calculamos los Faraday necesarios:
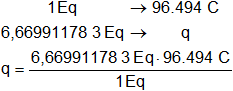
q = 6,669911783·96.494 C
q = 643.606,4676 C
Respuesta: la carga para la producción electrolítica de 245 g de NaClO₄ es 643.606 C.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP06
- | Siguiente ›
Ejemplo, cómo calcular la carga necesaria para que un elemento se deposite en el electrodo