Problema nº 9 de electrólisis. Primera ley de Faraday, masa depositada en un electrodo y tiempo que demora - TP06
Enunciado del ejercicio nº 9
En una cuba electrolítica se tiene en el cátodo una pieza cúbica de bronce de 3 cm de lado que se desea cromar con 0,03 mm de espesor. Para ello se emplea una disolución de cloruro de cromo III (CrCl₃), δ = 7,19 g/cm³. Se hace circular una corriente de 20 A. ¿Qué masa de cromo se empleará? ¿Cuánto tiempo demorará el proceso?
Desarrollo
Datos:
l = 3 cm
d = 0,03 mm
i = 20 A
δCr = 7,19 g/cm³
ζCr³⁺ = 0,000180 g/C (Dato de tabla)
Fórmulas:
![]()
m = ζ·i·t
Solución
a)
Para calcular la masa de cromo del recubrimiento, primero debemos hallar el volumen total de dicho recubrimiento. Para ello calculamos la superficie total del cubo y luego, conocido el espesor deseado, calculamos el volumen.
V = S·d
V = l²·d
Convertimos las unidades:
d = 0,03 mm = 0,03 mm·(1 cm/10 mm)
d = 0,003 cm
Reemplazamos por los datos y calculamos:
V = (3 cm)²·0,003 cm
V = 9 cm²·0,003 cm
V = 0,027 cm³
Tenemos el volumen, ahora empleamos la fórmula de densidad para hallar la masa:
![]()
Despejamos m:
m = δCr·V
Reemplazamos por los valores y calculamos:
m = 7,19 g/cm³·0,027 cm³
m = 0,19413 g
Respuesta a): la masa de cromo que debe depositarse en el cubo es 0,19 g.
b)
Para calcular el tiempo aplicamos la primera ley de Faraday:
m = ζ·i·t
Despejamos t:
![]()
Reemplazamos por los valores y calculamos:
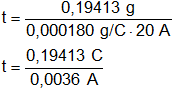
t = 53,925 s
Respuesta b): el tiempo que demanda el proceso es 54 s.
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP06
- | Siguiente ›
Ejemplo, cómo calcular la masa de un elemento que se deposita en el electrodo y tiempo que demora