Problema nº 2 de electrólisis. Primera ley de Faraday, corriente requerida - TP07
Enunciado del ejercicio nº 2
¿Cuántos amperios se necesitan para depositar en el cátodo 5,0 g de oro por hora de una disolución que contiene una sal de oro trivalente?
Desarrollo
Datos:
m = 5 g
t = 1 h
ζAu⁺³ = 0,000680 g/C *
Fórmulas:
m = ζ·i·t
Solución
Aplicamos la primera ley de Faraday para el oro trivalente:
m = ζ·i·t
Despejamos i:
![]()
Convertimos las unidades de tiempo:
![]()
t = 3.600 s
Reemplazamos por los valores dados y resolvemos:
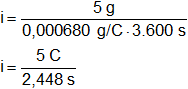
i = 2,04248366 A
Respuesta, la corriente necesaria para depositar 5,0 g de oro es:
i = 2,0 A
Resolvió: Ricardo Santiago Netto. Argentina
- ‹ Anterior |
- Regresar a la guía TP07
- | Siguiente ›
Ejemplo, cómo calcular la corriente necesaria para que un elemento se deposite en el electrodo